题目内容
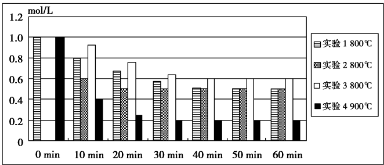
化学反应2HI=I2(g)+H2(g)在四种不同条件下进行,I2、H2的起始浓度均为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如柱状图所示.(其中实验2与实验3中HI的起始浓度在柱状图中均为画出,假设分别为c2和c3)
(1)实验1中,反应在0~10min以H2表示的平均反应速率v(H2)= mol/(L?min).
(2)根据柱状图推测实验2中,HI的初始浓度c2= mol/L,反应在20min时就已达到平衡,可推测实验2中还隐含的反应条件是 .
(3)40~60min内实验1的平均反应速率为v1,实验3的平均反应速率为v3,则v1v3(填“>”、“=”或“<”,下同),且c31.0 mol/L.
(4)比较实验4和实验1,可推测该反应是 反应(填“吸热”或“放热”);理由是 .
(5)若实验1平衡时HI的转化率为50%,实验3的平衡常数为K3,则K3的值为 .在实验2的反应条件下,若将I2、H2各1.0mol通入容积为1.0L的恒容密闭容器中,则平衡时HI的体积分数为 .
(1)实验1中,反应在0~10min以H2表示的平均反应速率v(H2)=
(2)根据柱状图推测实验2中,HI的初始浓度c2=
(3)40~60min内实验1的平均反应速率为v1,实验3的平均反应速率为v3,则v1v3(填“>”、“=”或“<”,下同),且c31.0 mol/L.
(4)比较实验4和实验1,可推测该反应是
(5)若实验1平衡时HI的转化率为50%,实验3的平衡常数为K3,则K3的值为

考点:化学平衡的计算
专题:
分析:(1)根据v=
计算出HI的速率,再利用速率之比等于计量数之比,计算出v(H2);
(2)比较平衡时实验1和实验2HI的浓度可判断出实验2中HI的初始浓度,根据影响化学反应速率的因素判断;
(3)根据影响反应速率的因素判断;
(4)根据影响平衡移动的因素判断;
(5)根据转化率可计算出实验1的平衡常数,根据温度不变,平衡常数不变,得出实验3和实验2的平衡常数,再利用平衡常数可计算出HI的体积分数.
| △c |
| t |
(2)比较平衡时实验1和实验2HI的浓度可判断出实验2中HI的初始浓度,根据影响化学反应速率的因素判断;
(3)根据影响反应速率的因素判断;
(4)根据影响平衡移动的因素判断;
(5)根据转化率可计算出实验1的平衡常数,根据温度不变,平衡常数不变,得出实验3和实验2的平衡常数,再利用平衡常数可计算出HI的体积分数.
解答:
解:(1)根据v=
计算出实验1中HI的速率为
mol/(L?min)=0.02mol/(L?min),根据速率之比等于计量数之比,得v(H2)=
(HI)=0.01mol/(L?min),
故答案为:0.01;
(2)根据实验1、2数据分析,温度相同,达平衡后HI的物质的量浓度相同,且I2、H2起始浓度为0,所以两组实验中HI的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后HI的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,故答案为:1.0;催化剂;
(3)实验1、3比较,温度相同,40~60min时,实验3、实验1都处于平衡状态,所以实验3的反应速率等于实验1的等于零,即v3=v1;由于实验1、3是在相同温度下进行的反应,且该反应前后气体体积不变,压强对平衡没有影响,而平衡时实验3的浓度高,所以实验3的起始浓度大于实验1的,即c3>1.0mol?L-1,
故答案为:=;>;
(4)实验4与实验1比,温度升高,达平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应.
故答案为:吸热;比较实验4与实验1,可看出升高温度,A的平衡浓度减小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应;
(5)若实验1平衡时HI的转化率为50%,则平衡常数K1=
=0.25,实验1、2、3的温度相同,所以它们的平衡常数也相同,所以K3=K2=1,在实验2的反应条件下,若将I2、H2各1.0mol通入容积为1.0L的恒容密闭容器中,得I2、H2的起始浓度都为1.0mol/L,设平衡时HI的浓度为xmol/L,则根据K2=
=0.25,得x=1,所以平衡时HI体积分数为
=0.5,
故答案为:1;0.5.
| △c |
| t |
| 1-0.8 |
| 10 |
| 1 |
| 2 |
故答案为:0.01;
(2)根据实验1、2数据分析,温度相同,达平衡后HI的物质的量浓度相同,且I2、H2起始浓度为0,所以两组实验中HI的起始浓度相同为1.0mol?L-1 ;温度相同,达平衡后HI的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,故答案为:1.0;催化剂;
(3)实验1、3比较,温度相同,40~60min时,实验3、实验1都处于平衡状态,所以实验3的反应速率等于实验1的等于零,即v3=v1;由于实验1、3是在相同温度下进行的反应,且该反应前后气体体积不变,压强对平衡没有影响,而平衡时实验3的浓度高,所以实验3的起始浓度大于实验1的,即c3>1.0mol?L-1,
故答案为:=;>;
(4)实验4与实验1比,温度升高,达平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应.
故答案为:吸热;比较实验4与实验1,可看出升高温度,A的平衡浓度减小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应;
(5)若实验1平衡时HI的转化率为50%,则平衡常数K1=
| 0.25×0.25 |
| 0.52 |
(1-
| ||
| x2 |
| 1 |
| 2 |
故答案为:1;0.5.
点评:本题考查了化学平衡化学反应速率的计算、平衡常数的计算及应用、影响反应速率及平衡移动的因素等知识点,题目难度中等,解题时注意基础知识的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某干燥粉末可能由Na2O、Na202、Na2C03、NaHC03、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定).若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A、.粉末中一定有Na20、Na202、NaHC03 |
| B、.粉末中一定不含有Na2C03和NaCl |
| C、粉末中一定不含有Na20和NaCl |
| D、.无法确定 |
足量铁片和100mL 5mol/L的稀H2SO4反应时,下列措施能加快H2的生成速率的是( )
| A、加入几滴CuSO4溶液 |
| B、加入少量6mol/L的稀盐酸 |
| C、升高温度 |
| D、不用稀硫酸,改用浓硝酸 |
能增加反应物分子的活化分子的百分数,同时可以改变转化率的是( )
| A、升高温度 | B、使用催化剂 |
| C、增大压强 | D、增加浓度 |
 在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)