题目内容
13.下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是( )| A. | CH3COOH | B. |  | C. | 升高温度 | D. | NaOH |
分析 A.醋酸电离得到氢离子,增大了氢离子浓度,水的电离平衡向左移动;
B.增大OH-的浓度,水的电离平衡向左移动;
C.升高温度促进水的电离;
D.增大OH-的浓度,水的电离平衡向左移动.
解答 解:A.醋酸电离得到氢离子,增大了氢离子浓度,抑制了水的电离,水的电离平衡向左移动,故A错误;
B.增大OH-的浓度,抑制了水的电离,水的电离平衡向左移动,故B错误;
C.水的电离过程为吸热过程,升高温度促进水的电离,水的电离平衡向右移动,故C正确;
D.加NaOH,增大OH-的浓度,抑制了水的电离,水的电离平衡向左移动,故D错误;
故选C.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意明确影响水的电离平衡的因素,侧重于基础知识的考查.

练习册系列答案
相关题目
10.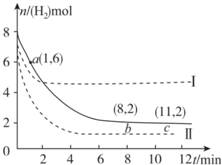 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
| A. | 纯碱溶液 | B. | 盐酸 | C. | 硫酸 | D. | 苛性钠溶液 |
8.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
18.下列说法中错误的是( )
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
2.下列化学反应在冶金工业中没有得到广泛应用的是( )
| A. | MgCl2(熔融) $\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑ | B. | Al2O3+3C $\frac{\underline{\;2125℃\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | HgS+O2$\frac{\underline{\;焙烧\;}}{\;}$ Hg+SO2 |
 所示.
所示.
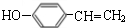 .
.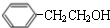 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$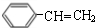 +H2O;C→D的反应类型为加成反应.
+H2O;C→D的反应类型为加成反应.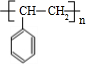 .
. )的叙述正确的是B(填字母序号)
)的叙述正确的是B(填字母序号)