题目内容
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )| A. | 纯碱溶液 | B. | 盐酸 | C. | 硫酸 | D. | 苛性钠溶液 |
分析 CaO与盐酸反应,而二氧化硅不能,则选择盐酸可除杂,以此来解答.
解答 解:A.CaO与水反应生成氢氧化钙,与碳酸钠反应生成NaOH,二氧化硅与NaOH反应,将原物质除去,不能除杂,故A不选;
B.CaO与盐酸反应,而二氧化硅不能,溶于足量盐酸后过滤可除杂,故B选;
C.CaO与硫酸反应生成硫酸钙微溶,不利于除杂,故C不选;
D.二氧化硅与NaOH反应,将原物质除去,不能除杂,故D不选;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9.已知锶(Sr)位于周期表第5周期第IIA族,则向饱和SrCO3溶液中加水,下列叙述正确的是( )
| A. | SrCO3的溶解度不变,KSP不变 | B. | SrCO3的溶解度不变,KSP增大 | ||
| C. | SrCO3的溶解度增大,KSP不变 | D. | SrCO3的溶解度减小,KSP增大 |
16.下列离子反应方程式书写正确的是( )
| A. | HClO与NaOH溶液反应 H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | Fe和稀H2SO4反应 2Fe+6H+═2Fe3++3H2↑ | |
| D. | 盐酸和Ba(OH)2溶液反应 H++OH-═H2O |
6.下列说法中正确的是( )
| A. | 在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率,称为牺牲阴极的阳极保护法 | |
| B. | 电解饱和食盐水是将电能转变成化学能,在阴极附近生成氢氧化钠和氢气 | |
| C. | 铜锌原电池反应中,铜片作正极,产生气泡发生还原反应,电子从铜片流向锌片 | |
| D. | 外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
13.下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A. | CH3COOH | B. |  | C. | 升高温度 | D. | NaOH |
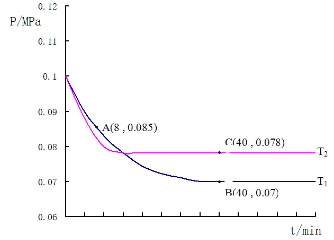 SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示: 利用周期表中同族元素的相似性,可预测元素的性质.
利用周期表中同族元素的相似性,可预测元素的性质.