题目内容
U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,其在W2中燃烧可生成淡黄色固体.Z的单质在W2中燃烧的产物可使品红溶液褪色.Y的单质也是一种金属,该金属在UW2中剧烈燃烧能生成黑、白两种固体.
请回答下列问题:
(1)V的单质分子的结构式为 ,YW的电子式为 ,X在周期表中的位置为 .
(2)U元素形成的同素异形体的晶体类型可能是(填序号) .
①原子晶体 ②离子晶体
③分子晶体 ④金属晶体
(3)U、V、W分别与氢元素可形成10电子氢化物.U、V的氢化物中沸点较低的是(写化学式) ,V、W的氢化物分子中结合H+能力较强的是(写化学式) ,请用一个离子方程式加以证明 .
(4)ZW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体VW,请用一个离子方程式表示有关反应 .
(5)已知通常状况下1g Z在W2中完全燃烧放出a kJ的热量,请写出表示Z燃烧热的热化学方程式 .
请回答下列问题:
(1)V的单质分子的结构式为
(2)U元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体
③分子晶体 ④金属晶体
(3)U、V、W分别与氢元素可形成10电子氢化物.U、V的氢化物中沸点较低的是(写化学式)
(4)ZW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体VW,请用一个离子方程式表示有关反应
(5)已知通常状况下1g Z在W2中完全燃烧放出a kJ的热量,请写出表示Z燃烧热的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素.Z的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Z为S元素,W为O元素;X的单质是一种金属,其在W2中燃烧可生成淡黄色固体,该淡黄色固体为Na2O2,则X为Na元素;U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素;V的原子序数介于碳元素与氧元素之间,则V为N元素;Y的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,据此答题;
解答:
解:(1)V为N元素,其单质为N2,结构为N≡N;YW为MgO,为离子化合物,电子式为 ;X为钠元素,位于周期表中第三周期第ⅠA族,
;X为钠元素,位于周期表中第三周期第ⅠA族,
故答案为:N≡N; ;第三周期第ⅠA族;
;第三周期第ⅠA族;
(2)C元素形成的单质有金刚石、无定形碳等,分别为原子晶体和分子晶体,
故答案为:①③;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,由于NH3分子之间有氢键存在,且氨分子是极性分子,所以氨的沸点比甲烷高,NH3的水溶液呈碱性,与水比较更易结合H+,可用NH3+H3O+=NH4++H2O的反应来证明,
故答案为:CH4;NH3;NH3+H3O+=NH4++H2O;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+;
(5)已知通常状况下1g S在O2中完全燃烧放出a kJ的热量,则1molS完全燃烧,可以放出32aKJ的热,所以Z燃烧热的热化学方程式为S(s)+O2(g)=SO2(g);△H=32aKJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=32aKJ/mol;
 ;X为钠元素,位于周期表中第三周期第ⅠA族,
;X为钠元素,位于周期表中第三周期第ⅠA族,故答案为:N≡N;
 ;第三周期第ⅠA族;
;第三周期第ⅠA族;(2)C元素形成的单质有金刚石、无定形碳等,分别为原子晶体和分子晶体,
故答案为:①③;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,由于NH3分子之间有氢键存在,且氨分子是极性分子,所以氨的沸点比甲烷高,NH3的水溶液呈碱性,与水比较更易结合H+,可用NH3+H3O+=NH4++H2O的反应来证明,
故答案为:CH4;NH3;NH3+H3O+=NH4++H2O;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+;
(5)已知通常状况下1g S在O2中完全燃烧放出a kJ的热量,则1molS完全燃烧,可以放出32aKJ的热,所以Z燃烧热的热化学方程式为S(s)+O2(g)=SO2(g);△H=32aKJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=32aKJ/mol;
点评:本题考查无机物的推断,题目难度中等,侧重于电子排布、电子式、氧化还原反应、热化学方程式的书写等知识的考查,注意根据物质的性质以及反应的现象进行判断.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
与250mL 0.4mol?L-1稀硫酸中的c(H+)相等的是( )
| A、100 mL 2 mol?L-1的盐酸溶液 |
| B、25 mL 0.8 mol?L-1的稀HNO3溶液 |
| C、100 mL 1 mol?L-1的稀H2SO4溶液 |
| D、250 mL 0.4 mol?L-1的稀盐酸溶液 |
浊液区别于其他分散系最本质的特征是( )
| A、外观混浊不清 |
| B、分散质粒子不能透过半透膜 |
| C、不稳定 |
| D、分散质粒子直径大于10-7m |
 如图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标,这里的钙、镁、钾、钠是指( )
如图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标,这里的钙、镁、钾、钠是指( )| A、元素 | B、原子 | C、单质 | D、分子 |
下列图示与对应的叙述相符的是( )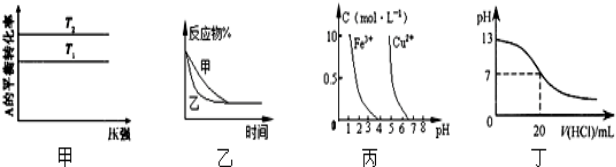

| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
下列关于砷(As)元素的叙述中,正确的是( )
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH等于7 |
| C、砷的氢化物的化学式为AsH3,其还原性比NH3的弱 |
| D、第一电离能:As<Se |

