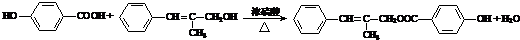题目内容
13.用惰性电极电解下列溶液,电解一段时间后,电解液的pH增大了的是( )| A. | H2SO4 | B. | Na2SO4 | C. | AgNO3 | D. | KOH |
分析 A.电解稀硫酸溶液时,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后硫酸浓度增大;
B.电解硫酸钠溶液,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后硫酸钠溶液浓度增大;
C.电解硝酸银溶液时,阴极上生成Ag,阳极上生成氧气,导致溶液中c(H+)增大;
D.电解KOH溶液时,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后KOH浓度增大.
解答 解:A.电解稀硫酸溶液时,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后硫酸浓度增大,则溶液的pH减小,故A错误;
B.电解硫酸钠溶液,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后硫酸钠溶液浓度增大,硫酸钠溶液呈中性,则溶液的pH不变,故B错误;
C.电解硝酸银溶液时,阴极上生成Ag,阳极上生成氧气,导致溶液中c(H+)增大,则溶液的pH减小,故C错误;
D.电解KOH溶液时,阴极上生成氢气、阳极上生成氧气,所以相当于生成水,导致电解后KOH浓度增大,则溶液的pH增大,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,注意ABD中溶液的体积减小但溶质的物质的量不变,导致溶液浓度增大,为易错点.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2.下列离子方程式的书写正确的是( )
| A. | 以石墨作电极电解饱和氯化钠溶液:2Cl-+2H2O$\stackrel{电解}{→}$ 2OH-+H2↑+Cl2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+→Fe3++3H2O | |
| C. | H218O中投入少量Na2O2固体:2H218O+2O22-→4OH-+18O2↑ | |
| D. | CuCl2溶液中加入NaHS溶液:Cu2++HS-→CuS↓+H+ |
3.有3种溶液①0.01mol•L-1醋酸; ②0.02mol•L-1醋酸与0.02mol•L-1NaOH等体积混合后的溶液;③0.04mol•L-1醋酸与0.02mol•L-1 NaOH等体积混合后的溶液.下列说法不正确的是( )
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |
1.下列实验操作中.不正确的是( )
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 用渗析法除去Fe(OH)3胶体中的Cl- | |
| C. | 除去溴乙烷中的乙醇,用水洗后,再用分液漏斗分离 | |
| D. | 用盐析法分离硬脂酸钠和甘油 |
5.下列说法正确的是( )
| A. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| B. | M层全充满而N层为4s2的原子与核外电子排布式为1s22s22p63s23p63d64s2的原子位于同一族 | |
| C. | 如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
 随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的阴极(填“阳”或“阴”),该极上的电极反应式是N2+6e-+6H+═2NH3.
随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).钯电极A是电解池的阴极(填“阳”或“阴”),该极上的电极反应式是N2+6e-+6H+═2NH3.