题目内容
8.在下列事实中,请说明是什么因素影响了化学反应速率:①黄铁矿煅烧时要粉碎成矿粒:固体表面积;
②双氧水常温常压下产生氧气较慢,加入少量MnO2则很快产生气体:催化剂;
③同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:反应物本身的性质;
④同样大小的石灰石分别与0.1mol•L-1盐酸和1mol•L-1盐酸反应,速率不同:浓度;
⑤夏天食品容易变质,而冬天不易发生该现象:温度.
分析 影响反应速率的因素有:温度、浓度、压强、催化剂、反应物接触面积等,温度和催化剂是通过改变活化分子百分数来改变反应速率,浓度、压强是通过改变单位体积内活化分子个数来改变反应速率,以此解答该题.
解答 解:①粉碎成矿粒增大了固体表面积,即影响因素为固体表面积,故答案为:固体表面积;
②MnO2起催化作用,即影响因素为催化剂,故答案为:催化剂;
③镁的活泼性比锌强,即影响因素为反应物本身的性质,故答案为:反应物本身的性质;
④盐酸的浓度不同反应速率不同,即影响因素为浓度,故答案为:浓度;
⑤夏天温度高于冬天,温度越高,活化分子百分数越大,其反应速率越大,所以食品在夏天容易变质,冬天则不会出现该现象,故答案为:温度.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、压强、浓度、催化剂、反应物接触面积对化学反应速率影响原理是解本题关键,题目难度不大.

练习册系列答案
相关题目
18.关于如图所示装置的叙述,正确的是( )
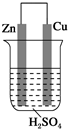

| A. | 铜极质量逐渐减少 | B. | 锌是正极,发生氧化反应 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 阳离子向铜极移动 |
15.如图所示的装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )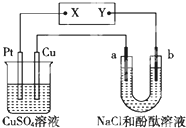

| A. | X是正极,Y是负极 | |
| B. | NaCl溶液中的Cl-移向b极 | |
| C. | CuSO4溶液的pH不变 | |
| D. | 理论上,a和b生成的气体的物质的量之比为1:2 |
3.在2000K时,反应CO(g)+$\frac{1}{2}$O2(g)?CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)?2CO(g)+O2(g)的平衡常数为( )
| A. | $\frac{1}{K}$ | B. | K2 | C. | ($\frac{1}{K}$)2 | D. | $(K)^{-\frac{1}{2}}$ |
13.用惰性电极电解下列溶液,电解一段时间后,电解液的pH增大了的是( )
| A. | H2SO4 | B. | Na2SO4 | C. | AgNO3 | D. | KOH |
17.室温时将浓度和体积分别为 c1、V1的 NaOH 溶液和 c2、V2的 CH3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若 pH>7,则一定是 c1V1═c2V2 | |
| B. | 在任何情况下都是 c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当 pH=7 时,若 V1=V2,则一定是 c1<c2 | |
| D. | 若 V1=V2、c1=c2,则 c(CH3COO-)+c(CH3COOH)═c(Na+) |
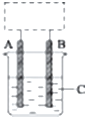 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答:
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═H2↑+CuSO4(未注明反应条件),试回答: