题目内容
4.燃烧0.2mol某烃,得到0.4mol CO2和0.6mol H2O,由此可得出的结论是①④.①该烃分子中含有2个碳原子和6个氢原子
②该烃的分子式为CH3
③该烃中含有2个CO2和3个H2O
④该烃中碳、氢的原子个数比为1:3.
分析 燃烧0.2mol某烃,得到0.4mol CO2和0.6mol H2O,根据元素守恒,则一个烃分子中含有2个碳原子和6个氢原子,分子式为C2H6,然后逐项分析.
解答 解:燃烧0.2mol某烃,得到0.4mol CO2和0.6mol H2O,根据元素守恒,则一个烃分子中含有2个碳原子和6个氢原子,分子式为C2H6;
①该烃分子中含有2个碳原子和6个氢原子,故①正确;
②该烃的分子式为C2H6,实验式为CH3,故②错误;
③不能说成有机物中含有CO2和H2O,故③错误;
④该烃中碳、氢的原子个数比为:2:6=1:3,故④正确;
故选①④.
点评 本题考查有机物燃烧的计算,难度不大,注意相对分子质量的确定.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
12.将0.1mol两种气态烃组成的混合气体,完全燃烧后得到3.36L二氧化碳(标准状况下)和3.6g水,下列说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
9.某溶液中可能含有物质的量浓度相等的下列离子中的几种:Fe3+、Cu2+、Na+、H+、Cl-、SO42-、CO32-、I-,取少量上述溶液分别进行如下实验:①一份中加人少量锌粉后,固体溶解完但无其他变化;②一份加入BaCl2溶液后得到白色沉淀,下列有关判断正确的是( )
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-但无法确定有无Cl- |
1. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
 (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).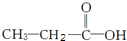 和
和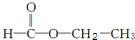 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.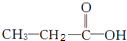 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
