题目内容
20.某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):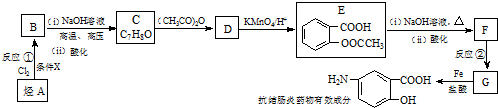
已知:
(a)
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b)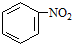 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
请回答下列问题:
(1)烃A的结构简式是
 ;
;反应①的反应条件是Fe或氯化铁;反应②的反应类型是取代反应或硝化反应;
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是AD;
A.水溶性比苯酚好 B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与3mol溴发生反应 D.既有酸性又有碱性
②E与足量NaOH溶液反应的化学方程式是
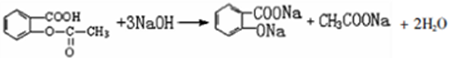 ;
;(3)写出符合下列条件的E的所有同分异构体的结构简式:
a.与E具有相同的官能团 b.苯环上的一硝基取代产物有两种
 ;
;(4)已知苯胺(
 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原
料合成邻氨基苯甲酸(
 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条件已略去)
 .
.
分析 烃A和氯气发生取代反应生成B,B发生水解反应然后酸化得到C,从A到B、B到C反应过程中碳原子个数不变,所以A为 ,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为
,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为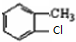 ,C为
,C为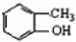 ,C和乙酸酐发生取代反应生成D,D为
,C和乙酸酐发生取代反应生成D,D为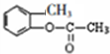 ,D
,D
被氧化生成E,E水解然后酸化得到F,F结构简式为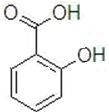 ,G和Fe、盐酸反应生成
,G和Fe、盐酸反应生成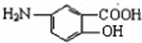 ,结合题给信息知,G为
,结合题给信息知,G为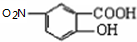 ,F发生取代反应生成G,据此分析解答.
,F发生取代反应生成G,据此分析解答.
解答 解:烃A和氯气发生取代反应生成B,B发生水解反应然后酸化得到C,从A到B、B到C反应过程中碳原子个数不变,所以A为 ,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为
,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为 ,C为
,C为 ,C和乙酸酐发生取代反应生成D,D为
,C和乙酸酐发生取代反应生成D,D为 ,D
,D
被氧化生成E,E水解然后酸化得到F,F结构简式为 ,G和Fe、盐酸反应生成
,G和Fe、盐酸反应生成 ,结合题给信息知,G为
,结合题给信息知,G为 ,F发生取代反应生成G,
,F发生取代反应生成G,
(1)根据上面的分析可知,烃A的结构简式是 ,反应①的反应条件是Fe或氯化铁作催化剂;反应②的反应类型是取代反应或硝化反应,
,反应①的反应条件是Fe或氯化铁作催化剂;反应②的反应类型是取代反应或硝化反应,
故答案为: ;Fe或氯化铁;取代反应或硝化反应;
;Fe或氯化铁;取代反应或硝化反应;
(2)①A.该分子中含有酚羟基、羧基及氨基,都属于亲水基,所以水溶性比苯酚好,故正确;
B.该分子中含有酚羟基、羧基和氨基,不能发生消去反应,故错误;
C.1mol该物质最多可与1mol溴发生反应,故错误;
D.含有羧基和氨基,具有氨基酸的性质,所以既有酸性又有碱性,故正确;
故选AD;
②E与足量NaOH溶液反应的化学方程式是 ,
,
故答案为: ;
;
(3)E的同分异构体符合下列条件:a.与E具有相同的官能团说明含有酯基和羧基,
b.苯环上的一硝基取代产物有两种,说明苯环上氢原子有两种,符合条件的同分异构体有 ,
,
故答案为: ;
;
(4)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸,其合成路线为 ,两种中间产物的结构简式为
,两种中间产物的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机合成和有机推断,侧重考查学生分析推断及合成路线设计能力,明确官能团及其性质关系是解本题关键,根据反应物、目标产物结构简式结合反应条件进行推断,注意题给信息的合理运用,注意反应先后顺序,题目难度中等.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案| A. |  用装置制备Fe(OH)2并能较长时间观察其颜色 | |
| B. |  用装置制备并收集少量氨气 | |
| C. |  用装置除去H2S中的水蒸气 | |
| D. |  用装置制取纯净的乙酸乙酯 |
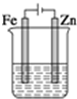
| A. | 溶液中氯离子向锌电极移动 | B. | 锌电极上生成氧化产物 | ||
| C. | 两端电极产生相等体积的气体 | D. | 电路中电子转移数为0.4NA |
①Fe(OH)3 ②Fe(NO3)2 ③NaHCO3 ④Al2S3 ⑤NH4Cl ⑥NaOH.
| A. | ④除外都可以 | B. | 除②④外都可以 | C. | 只有①⑤⑥可以 | D. | 全部都可以 |
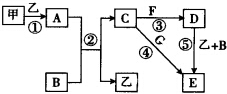 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色. ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为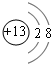 .
.