题目内容
5.用图示装置电解饱和食盐水,当生成气体体积为4.48L(标况)时,下列说法正确的是( )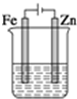
| A. | 溶液中氯离子向锌电极移动 | B. | 锌电极上生成氧化产物 | ||
| C. | 两端电极产生相等体积的气体 | D. | 电路中电子转移数为0.4NA |
分析 用图示装置电解饱和食盐水,阳极上是金属铁失电子的氧化反应,电极本身质量减小,在阴极上是氢离子得到电子的还原反应,产生的是氢气,根据电解池的工作原理来回答.
解答 解:用图示装置电解饱和食盐水,Fe是阳极,Zn是阴极,
A、溶液中阴离子移向阳极,所以氯离子向Fe电极移动,故A错误;
B、Zn是阴极,该电极上发生还原反应,得到的产物是还原产物,故B错误;
C、Fe是阳极,该电极上是金属电极本身失电子,不会产生气体,故C错误;
D、Fe是阳极,该电极上是金属电极本身失电子,阴极上产生的是氢气,2H++2e-=H2↑,所以产生氢气4.48L,即0.2mol,转移电子是0.,4mol,即电路中电子转移数0.4NA,故D正确.
故选D.
点评 本题是一道电化学综合知识题目,主要是电解池原理的分析应用,电极判断和电极反应是解题关键,注意电解池中活性电极做阳极,本身失电子发生氧化反应,掌握基础是关键,题目难度中等.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
16. 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
(1)X元素在元素周期表中的位置第二周第ⅣA族_.
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为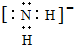 .
.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能(填“能”或“不能”)用来腌制咸菜,原因是氯离子会破坏铝表面氧化膜.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.关于该电池的下列说法,正确的是AC
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:5C2O42-+2MnO${\;}_{4}^{-}$+16H+═5CO2+2Mn2++8H2O.
 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
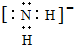 .
.(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能(填“能”或“不能”)用来腌制咸菜,原因是氯离子会破坏铝表面氧化膜.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.关于该电池的下列说法,正确的是AC
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:5C2O42-+2MnO${\;}_{4}^{-}$+16H+═5CO2+2Mn2++8H2O.
14.关于下列各装置图的叙述中,正确的是( )

| A. | 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的正极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |

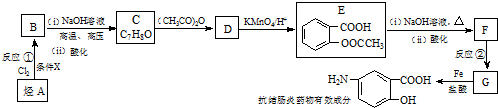
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b)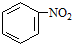 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 ;
;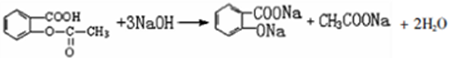 ;
; ;
; )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条 .
.
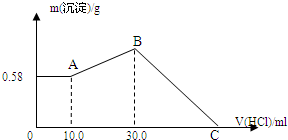 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.