题目内容
(I)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面.下图是某工厂对海水资源进行综合利用的示意图.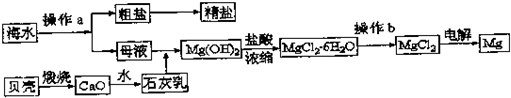
回答下列问题:
(1)实验室中除去粗盐中不溶性杂质的操作名称为溶解、过滤、 .操作b通常在氯化氢的氛围中加热进行,其目的是: .
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①通入的气体A、气体B是CO2或NH3,则气体B应是 .
②工业制取NH3的化学方程式为
(II)现测定某碳酸钠样品(仅含未分解的碳酸氢钠)中Na2CO3的质量分数.
方案一:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算.
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 .
(2)实验中判断沉淀是否完全的方法是: .
方案二:按如图所示装置进行实验:
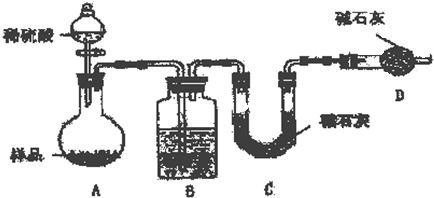
(1)B装置应盛放的试剂是 ;其作用是
(2)实验前称取19.0g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为 .
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显的缺陷是 .

回答下列问题:
(1)实验室中除去粗盐中不溶性杂质的操作名称为溶解、过滤、
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①通入的气体A、气体B是CO2或NH3,则气体B应是
②工业制取NH3的化学方程式为
(II)现测定某碳酸钠样品(仅含未分解的碳酸氢钠)中Na2CO3的质量分数.
方案一:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算.
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是:
方案二:按如图所示装置进行实验:

(1)B装置应盛放的试剂是
(2)实验前称取19.0g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显的缺陷是
考点:海水资源及其综合利用,物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(Ⅰ)(1)根据过滤具体操作判断所需仪器;如果直接在空气中加热MgCl2?6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②工业制取NH3的化学方程式为氮气和氢气在催化剂作用下高温高压反应生成氨气;
(Ⅱ)方案一、(1)根据过滤具体操作判断所需仪器;
(2)试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
方案二、(1)B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定;
(2)依据碳酸钠和碳酸氢钠和硫酸反应的定量关系计算得到;
(3)装置中的二氧化碳不一定被C全部吸收.
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②工业制取NH3的化学方程式为氮气和氢气在催化剂作用下高温高压反应生成氨气;
(Ⅱ)方案一、(1)根据过滤具体操作判断所需仪器;
(2)试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
方案二、(1)B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定;
(2)依据碳酸钠和碳酸氢钠和硫酸反应的定量关系计算得到;
(3)装置中的二氧化碳不一定被C全部吸收.
解答:
解:(Ⅰ)(1)实验室中除去粗盐中不溶性杂质的操作名称为溶解、过滤、洗涤;操作b通常在氯化氢的氛围中加热进行,如果直接在空气中加热MgCl2?6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;
故答案为:洗涤;抑制氯化镁在水溶液中水解;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,先通入氨气再通入二氧化碳能提高二氧化碳溶解性,更多析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
Na2CO3+CO2↑+H2O;
故答案为:CO2;
②工业制取NH3的化学方程式为氮气和氢气在催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2
2NH3,
故答案为:N2+3H2
2NH3,;
(Ⅱ)方案一、(1)过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流,故答案为:玻璃棒;
(2)试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
方案二、(1)实验前应检查装置的气密性,防止装置漏气,装置B中为浓H2SO4,可干燥二氧化碳,故答案为:浓H2SO4;干燥二氧化碳;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
解得x=0.1mol,y=0.1mol
则样品中NaCO3的质量分数
×100%=55.8%,故答案为:55.8%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不一定被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一个装置将A、B中的CO2全部吹入C中吸收.
故答案为:洗涤;抑制氯化镁在水溶液中水解;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,先通入氨气再通入二氧化碳能提高二氧化碳溶解性,更多析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
| ||
故答案为:CO2;
②工业制取NH3的化学方程式为氮气和氢气在催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2
| ||
| 高温高压 |
故答案为:N2+3H2
| ||
| 高温高压 |
(Ⅱ)方案一、(1)过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流,故答案为:玻璃棒;
(2)试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
方案二、(1)实验前应检查装置的气密性,防止装置漏气,装置B中为浓H2SO4,可干燥二氧化碳,故答案为:浓H2SO4;干燥二氧化碳;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
|
解得x=0.1mol,y=0.1mol
则样品中NaCO3的质量分数
| 0.1mol×106g×/mol |
| 19.0g |
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不一定被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一个装置将A、B中的CO2全部吹入C中吸收.
点评:本题主要考查了粗盐的提纯、候氏制碱、海水中提取Mg的原理、利用方程式计算,实验装置分析判断,难度中等,根据所学知识和题干信息分析回答.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
若在加入铝粉能放出氢气的溶液,分别加入下列各组离子,可能大量共存的是( )
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、CH3COO- Fe3+ K+ Cl- |
| D、NO3- K+ AlO2- OH- |
t℃时,水的离子积为Kw,该温度下将a mol?L-1 一元酸HA与b mol?L-1 一元碱BOH等体积混合,混合液一定呈中性的是( )
| A、混合液的pH=7 |
| B、混合液中c(B+)=c(A-) |
| C、a=b |
| D、加入甲基橙显橙色 |

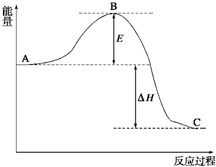 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.