题目内容
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(溶剂不变),发生如下反应:3A(g)+B(g)?xC(g)2min时反应达到平衡状态(温度不变),剩余0.8molB,并测定C的浓度为0.4mol/L,请填写下列空白:
(1)从开始至达到平衡的状态,生成C平均反应速度为 .
(2)x= ;平衡常数K= .
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动.
(1)从开始至达到平衡的状态,生成C平均反应速度为
(2)x=
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动.
考点:化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,平衡状态并测定C的浓度为0.4mol/L,物质的量为0.8mol
3A(g)+B(g)?xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
依据平衡计算结果分析计算反应速率,平衡常数,结合平衡移动原理分析判断平衡移动方向.
3A(g)+B(g)?xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
依据平衡计算结果分析计算反应速率,平衡常数,结合平衡移动原理分析判断平衡移动方向.
解答:
解:平衡状态并测定C的浓度为0.4mol/L,物质的量为0.8mol,则
3A(g)+B(g)?xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
(1)从开始至达到平衡的状态,生成C平均反应速度=
=0.2mol/L?min,故答案为:0.2mol/L?min;
(2)上述计算可知x=4,平衡常数K=
=
,故答案为:4;
;
(3)若继续向原混合物的容器中通入少量氦气,恒温恒容容器,加入惰气总压增大,分压不变,平衡不动,故答案为:C.
3A(g)+B(g)?xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8
x=4
(1)从开始至达到平衡的状态,生成C平均反应速度=
| ||
| 2min |
(2)上述计算可知x=4,平衡常数K=
(
| ||||
(
|
| 1 |
| 27 |
| 1 |
| 27 |
(3)若继续向原混合物的容器中通入少量氦气,恒温恒容容器,加入惰气总压增大,分压不变,平衡不动,故答案为:C.
点评:本题考查了化学反应速率,平衡常数概念计算的分析应用,主要是计算方法和平衡移动原理的理解,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
在一定温度下,反应
H2(g)+
X2(g)?HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、9.1% | B、10.0% |
| C、28.6% | D、71.5% |
下列与有机物结构、性质相关的叙述错误的是( )
| A、乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应 |
| B、乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、乙烯和苯都能发生加成反应 |
下列电离方程式错误的是( )
| A、HCl=H++Cl- | ||
B、Al(NO3)3=Al3++3NO
| ||
C、Na2CO3=2Na++CO
| ||
D、MgCl2=Mg2++Cl
|
下列关系正确的是( )
| A、原子半径:C1>S>P |
| B、热稳定性:HC1>H2S>H2O |
| C、还原性:I->Br->C1- |
| D、碱性:NaOH>Mg(OH)2>Ca(OH)2 |
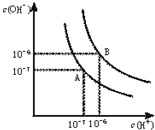 (1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从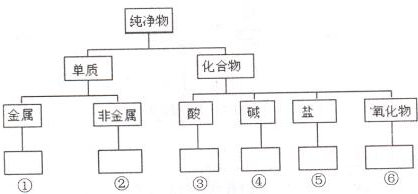 在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:
在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内: