题目内容
下列关系正确的是( )
| A、原子半径:C1>S>P |
| B、热稳定性:HC1>H2S>H2O |
| C、还原性:I->Br->C1- |
| D、碱性:NaOH>Mg(OH)2>Ca(OH)2 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.同一周期从左到右原子半径逐渐减小;
B.非金属性越强,氢化物越稳定;
C.同一主族从上到下阴离子的还原性逐渐增强;
D.元素的金属性越强,则其对应的最高价氧化物的水化物的碱性越强.
B.非金属性越强,氢化物越稳定;
C.同一主族从上到下阴离子的还原性逐渐增强;
D.元素的金属性越强,则其对应的最高价氧化物的水化物的碱性越强.
解答:
解:A.同一周期从左到右原子半径逐渐减小,则原子半径:P>S>Cl,故A错误;
B.非金属性越强,氢化物越稳定,非金属性:O>Cl>S,则热稳定性:H2O>HC1>H2S,故B错误;
C.同一主族从上到下阴离子的还原性逐渐增强,所以还原性:I->Br->C1-,故C正确;
D.元素的金属性越强,则其对应的最高价氧化物的水化物的碱性越强,金属性:Ca>Na>Mg,则碱性:Ca(OH)2>NaOH>Mg(OH)2,故D错误;
故选C.
B.非金属性越强,氢化物越稳定,非金属性:O>Cl>S,则热稳定性:H2O>HC1>H2S,故B错误;
C.同一主族从上到下阴离子的还原性逐渐增强,所以还原性:I->Br->C1-,故C正确;
D.元素的金属性越强,则其对应的最高价氧化物的水化物的碱性越强,金属性:Ca>Na>Mg,则碱性:Ca(OH)2>NaOH>Mg(OH)2,故D错误;
故选C.
点评:本题考查了元素周期律的有关知识,主要涉及半径的比较、非金属性和金属性的比较等,题目难度不大,注意学习中对基础知识积累掌握.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列实验能获得成功的是( )
| A、苯、溴水、铁粉混合制成溴苯 |
| B、加浓溴水,然后过滤可除去苯中少量苯酚 |
| C、用高锰酸钾酸性溶液来区别甲烷和乙烯 |
| D、可用水来鉴别苯跟四氯化碳 |
主族元素的原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子.下列各原子或离子的电子排布式中,错误的是( )
| A、S2-1s22s22p63s23p4 |
| B、F1s22s22p5 |
| C、K+1s22s22p63s23p6 |
| D、Ar1s22s22p63s23p6 |
98%的浓H2SO4,ρ=1.84g/cm3,其物质的量浓度是( )
| A、0.25mol/L |
| B、18.4mol/L |
| C、1.84mol/L |
| D、1.0mol/L |
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| B、c点表示CH3COOH和NaOH恰好反应完全 | ||
| C、a、b点间一定存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
D、b、d点表示的溶液中
|
物质的量相同的NH3和CH4两种气体,一定具有相同的( )
| A、体积 | B、质量 |
| C、原子个数 | D、质子数 |
单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
| A、①③⑤ | B、①②④ |
| C、③④⑤ | D、①④⑤ |
关于下列图示的说法中正确的是( )
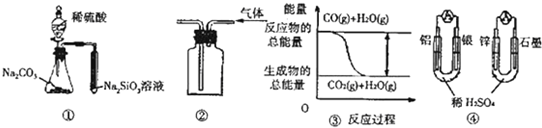

| A、用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图 ②所示实验装置排空气法收集CO2气体 |
| C、图 ③表示CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 |
| D、图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |