题目内容
下列实验操作正确的是( )
A、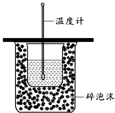 用如图装置测定中和热 |
| B、中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化 |
| C、研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 |
| D、测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
考点:化学平衡的影响因素,中和热,测定溶液pH的方法
专题:
分析:A.装置中没有环形玻璃搅拌棒;
B.滴定时根据溶液颜色变化判断终点;
C.应该加入较大浓度的硫酸;
D.测pH时,试纸不能湿润.
B.滴定时根据溶液颜色变化判断终点;
C.应该加入较大浓度的硫酸;
D.测pH时,试纸不能湿润.
解答:
解:A.测定中和热时要用环形玻璃搅拌棒搅拌使溶液的温度均匀,该装置中没有环形玻璃搅拌棒,故A错误;
B.滴定时根据溶液颜色变化判断终点,所以中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化,故B正确;
C.研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,应该加入较大浓度的硫酸,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸,氢离子浓度为0.2mol/L,对平衡无影响,故C错误;
D.测pH时,试纸不能湿润,则测定溶液的pH值时,用玻璃棒蘸取少量溶液点在pH试纸上再与标准比色卡对照,故D错误.
故选B.
B.滴定时根据溶液颜色变化判断终点,所以中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化,故B正确;
C.研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,应该加入较大浓度的硫酸,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸,氢离子浓度为0.2mol/L,对平衡无影响,故C错误;
D.测pH时,试纸不能湿润,则测定溶液的pH值时,用玻璃棒蘸取少量溶液点在pH试纸上再与标准比色卡对照,故D错误.
故选B.
点评:本题考查了基本实验操作,涉及中和热的测定、中和滴定、平衡移动、pH的测定,题目难度不大,侧重于考查学生的实验能力.

练习册系列答案
相关题目
下列电离方程式中,正确的是( )
| A、H2SO4=H2++SO42- |
| B、Ba(OH)2=Ba2++OH- |
| C、NaNO3=Na++NO3- |
| D、MgSO4═Mg+2+SO4-2 |
一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+
O2(g)→4CO2(g)+5H2O(g)的△H为( )
| 13 |
| 2 |
| A、+2590.4kJ/mol |
| B、-2590.4kJ/mol |
| C、+1295.2kJ/mol |
| D、-1295.2kJ/mol |
将等物质的量的甲烷与氯气在光照条件下反应,得到的产物最多的是( )
| A、HCl |
| B、CH2Cl2 |
| C、CH3Cl |
| D、CCl4 |
