题目内容
19.浓硫酸为什么不能干燥NH3、H2S、HBr、HI等气体?分析 浓硫酸具有酸性,可与碱性气体反应,具有强氧化性,可与具有强还原性的气体发生氧化还原反应,以此解答该题.
解答 解:浓硫酸具有酸性,可与氨气反应生成硫酸铵,具有强氧化性,可与具有强还原性的H2S、HBr、HI等气体发生氧化还原反应,
答:浓硫酸与NH3、H2S、HBr、HI等气体反应.
点评 本题考查浓硫酸的性质,侧重考查气体的干燥,为高频考点,注意把握浓硫酸的性质、常见干燥剂以及常见气体的干燥方法,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)是制备硫酸过程中的一步重要反应,下列叙述正确的是( )
| A. | 催化剂不会改变该反应的逆反应速率 | |
| B. | 增大SO2(g)的浓度,逆反应速率会减小 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
10.下列叙述正确的是( )
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水硫酸铜粉末溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将0.2mol/L稀硫酸与等质量的蒸馏水混合后,浓度大于0.1mol/L | |
| D. | 将1体积1mol/L的稀硫酸用水稀释到5体积,溶液的浓度为0.2mol/L |
7.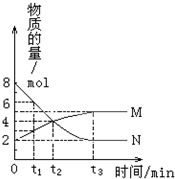 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,保持恒温恒容,再充入N,N的转化率保持不变 | |
| D. | t3时,其他条件不变,改变温度,平衡一定发生移动 |
4.3.15g镁铝合金完全溶于稀硝酸.若反应中硝酸被还原只产生2.24L(标准状况下)NO气体,在反应后的溶液中加认足量1mo1•L-1的NaOH溶液.生成沉淀的质量为( )
| A. | 8.7g | B. | 3.15g | C. | 4.35g | D. | 4.0g |
4.光导纤维的主要化学成分( )
| A. | 二氧化硅 | B. | 硅 | C. | 硅酸 | D. | 硅酸钠 |
