题目内容
2.下列有关说法,不正确的是( )①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
⑥用FeCl3溶液腐蚀铜制印刷电路板:2Fe3++Cu=2Fe2++Cu2+.
| A. | 仅①③④⑤ | B. | 仅②③④ | C. | 仅①③④ | D. | 仅①②④⑤ |
分析 ①依据二氧化氮和水反应的气体体积变化分析判断;
②依据二氧化硫与氧化钙反应生成亚硫酸钙,亚硫酸钙不稳定,易被氧化生成硫酸钙解答;
③氢氧化钠能够与二氧化硅发生反应;
④电解从海水中得到的氯化镁溶液可获得氢氧化镁、氯气和氢气;
⑤碳酸钠、碳酸氢钠都能够与氢氧化钙反应生成碳酸钙沉淀;
⑥铁离子与铜反应生成亚铁离子和铜离子.
解答 解:①二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,反应后水上升试管容积的三分之二,不能充满液体,故①错误;
②向煤中加入适量石灰石,发生反应:CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4,可减少SO2对大气的污染,故②正确;
③石英坩埚主要成分为二氧化硅,二氧化硅为酸性氧化物,能够与氢氧化钠反应,故③错误;
④电解从海水中得到的氯化镁溶液可获得氢氧化镁、氯气和氢气,电解熔融的氯化镁可得到Mg,故④错误;
⑤碳酸钠、碳酸氢钠都能够与氢氧化钙反应生成碳酸钙沉淀,无法用加入澄清石灰水的方法证明NaHCO3溶液中混有Na2CO3,故⑤错误;
⑥用FeCl3溶液腐蚀铜制印刷电路板,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故⑥正确;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及元素及化合物的性质、电解原理,明确物质的性质是解题关键,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
7.为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
②写出实验操作“步骤一”中的反应离子方程式:4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓.
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
14.下列说法正确的是( )
| A. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定是纯净物 |
 $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯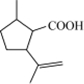 .
.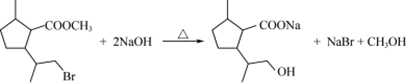 .
.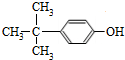 .
. 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).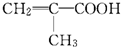 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$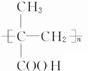 .
.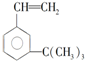 有如下性质:
有如下性质: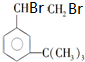 .
.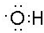 ;
;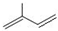 ;
;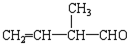 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.