题目内容
14.在150℃条件下,将20mL的氢气和氧气的混合气体点燃后,恢复到原状况,剩余16mL气体,则混合气体中氢气和氧气的体积各多少?分析 燃烧发生反应:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,利用差量法计算参加反应的氢气、氧气体积,剩余气体可能为H2,也可能为O2,据此讨论计算H2和O2的体积,相同条件下,气体分子数目之比等于其体积之比.
解答 解:2 H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O△V
2 1 2 1
8 4 20mL-16mL=4mL
若剩余气体为H2,则混合气体中氢气为20mL-4mL=16mL,则混合气体中氢气是16ml和氧气的体积4ml;
若剩余气体为O2,故混合气体中氧气为20-8=12mL,则混合气体中氢气是8ml和氧气的体积12ml;
答:若剩余气体为H2,则混合气体中氢气为20mL-4mL=16mL,则混合气体中氢气是16ml和氧气的体积4ml;
若剩余气体为O2,故混合气体中氧气为20-8=12mL,则混合气体中氢气是8ml和氧气的体积12ml.
点评 本题考查混合物计算,难度不大,关键是讨论确定剩余的气体,再结合方程式计算,注意差量法的应用.

练习册系列答案
相关题目
4.在自然界里,既有以游离态又有以化合态的形式存在的元素是( )
| A. | Cl | B. | P | C. | S | D. | Na |
5.关于3mol NO,下列说法正确的是( )
| A. | 质量为30 g | |
| B. | 含有6.02×1023个NO子 | |
| C. | 标准状况下的体积为67.2L | |
| D. | 与足量氧气完全反应,生成6mol NO2 |


 :CH2=CHCH3、CH2=CH2
:CH2=CHCH3、CH2=CH2 HOCH2CH2OH、
HOCH2CH2OH、 、H2N(CH2)4COOH.
、H2N(CH2)4COOH. .
. .
.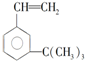 有如下性质:
有如下性质: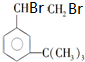 .
.