题目内容
16. 某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.
某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.根据下列步骤完成实验:
①装配好装置,检查气密性
②用砂纸擦去镁带表面的氧化物,然后取0.0480g的镁带加入仪器a中,分液漏斗内加入足量1mol/L硫酸溶液
③量气装置中加入适量水,记录量气管读数(读数为0.10mL)
④通过分液漏斗向仪器a中加入适量硫酸溶液,使镁带与硫酸充分反应
⑤当镁带完全反应后,再次记录量气管读数(读数为49.60mL).
完成下列填空:
(1)仪器a的名称锥形瓶,通过分液漏斗向仪器a中加入硫酸溶液的操作是将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或将玻璃塞拔开),缓慢旋转分液漏斗的旋塞,使硫酸溶液缓慢流入锥形瓶,适时关闭旋塞.
(2)在记录量气管读数时,应注意将装置冷却至室温,再调节水准管高度,使其液面与量气管中液面相平,视线与量气管内凹液面相切,水平读数.
(3)该同学测出此条件下气体摩尔体积为24.75L•mol-1,测定结果比理论值偏大,可能的原因是(填字母代号)bc.
a.镁带中氧化膜未除尽 b.镁带含有杂质铝
c.③记录量气管读数时俯视读数 d.镁带完全反应后有残留的未溶固体
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高.请说明理由为避免加入硫酸时,液体所占的体积引入的实验误差.
分析 (1)由图可知仪器的名称,利用气体的压强使液体顺利流下;
(2)记录量气管读数时,在常温下进行,且调节液面相平;
(3)Mg~H2↑,气体的物质的量等于Mg的物质的量,均为$\frac{0.048g}{24g/mol}$=0.002mol,气体体积为49.60mL-0.10mL=49.50mL,结合Vm=$\frac{V}{n}$计算;测定结果比理论值偏大,则气体体积偏大;
(4)用装置B代替装置A,实验精确度更高,可避免液体体积对实验的影响.
解答 解:(1)仪器a的名称为锥形瓶,通过分液漏斗向仪器a中加入硫酸溶液的操作是 将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或将玻璃塞拔开),缓慢旋转分液漏斗的旋塞,使硫酸溶液缓慢流入锥形瓶,适时关闭旋塞,
故答案为:锥形瓶;将分液漏斗玻璃塞上的凹槽与漏斗口颈上的小孔对准(或将玻璃塞拔开),缓慢旋转分液漏斗的旋塞,使硫酸溶液缓慢流入锥形瓶,适时关闭旋塞;
(2)在记录量气管读数时,应注意将装置冷却至室温,再调节水准管高度,使其液面与量气管中液面相平,视线与量气管内凹液面相切,水平读数,
故答案为:装置冷却至室温;调节水准管高度,使其液面与量气管中液面相平;
(3)Mg~H2↑,气体的物质的量等于Mg的物质的量,均为$\frac{0.048g}{24g/mol}$=0.002mol,气体体积为49.60mL-0.10mL=49.50mL,此条件下气体摩尔体积为$\frac{0.0495L}{0.002mol}$=24.75 L•mol-1; 测定结果比理论值偏大,则气体体积偏大,b、c均符合,
故答案为:24.75 L•mol-1;bc;
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高.理由为避免加入硫酸时,液体所占的体积引入的实验误差,
故答案为:为避免加入硫酸时,液体所占的体积引入的实验误差.
点评 本题考查气体摩尔体积的测定实验,为高频考点,把握实验装置的作用、实验技能为解答关键,侧重分析与实验能力的考查,注意测定原理,题目难度不大.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案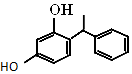 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 分子式为C14H14O2 | |
| C. | 1 mol该物质与溴水反应时最多能消耗2 mol的Br2 | |
| D. | 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊 |
| A. | 在标准状况下,78g苯的碳碳双键数目为3NA | |
| B. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| C. | 500mL2mol/LNH4NO3溶液中,含有氮原子数目为2NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子数效目一定为NA |
| A. | Y4X10分子中,极性键和非极性键的个数比为10:4 | |
| B. | Z和W形成的多种化合物中只有一种能与水反应 | |
| C. | 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7 | |
| D. | 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等 |
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 向浓度均为1×10-4 mol/L的KCl和K2CrO4混合液中逐滴加入1×10-3 mol/LAgNO3溶液,CrO42-先沉淀(10-5 mol/L是否太小?这个浓度一般都认为沉淀完全了) | |
| B. | H2CO3、HCO3-、CH3COO-、ClO-在溶液中可以大量共存 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液,各离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+) | |
| D. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+HClO |
 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.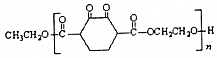 )是人造棉的主要成分之一,合成线路如图:
)是人造棉的主要成分之一,合成线路如图: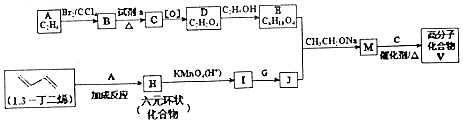
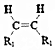 $\stackrel{KMnO_{4}/H+}{→}$2R1COOH
$\stackrel{KMnO_{4}/H+}{→}$2R1COOH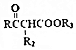 +R1OH
+R1OH CH3CH2OOC-COOCH2CH3+2H2O.
CH3CH2OOC-COOCH2CH3+2H2O. .
.