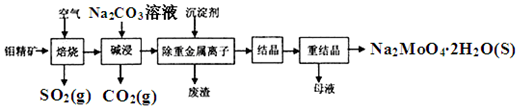
题目内容
20.元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示.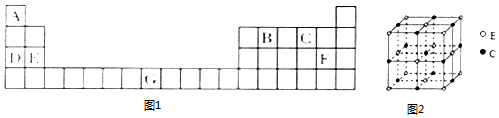
回答下列问题:
(1)G的基态原子核外电子排布式为1s22s22p63s23p63d64s2;原子的第一电离能:D<E(填“>”或“<”).
(2)根据价层电子对斥理论,A2C中的“A-C-A”键角是D(填字母序号).
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28ˊ,但小于109°28ˊ
(3)已知化合物G(BC)5的G元素化合价为0,熔点为-20℃,沸点为103℃,其固体属于分子晶体,该物质中存在的化学键类型有配位键、共价键,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为4Fe(CO)3+13O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+20CO2.
(4)化合物BCF2的分子立体构型为平面三角形,其中B原子的杂化轨道类型是sp2.写出一个与BCF2具有相同空间构型的含氧酸根离子符号NO3-或CO32-等.
(5)化合物EC的晶胞结构如图2所示.每个晶胞中含有4个E2+.若EC晶体的密度为dg•cm-3,阿伏伽德罗常数值为NA,则晶胞参数a=$\root{3}{\frac{160×1{0}^{21}}{{N}_{A}d}}$nm(列出计算式,不要求最终结果).
分析 由元素在周期表中的位置,可知A为H、B为C元素、C为O元素、D为Na元素、E为Mg元素、F为Cl元素、G为Fe元素.
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大;
(2)H2O的σ键电子对数为2,孤电子对数为$\frac{1}{2}×$(6-2×1)=2,空间结构为V形;
(3)该化合物是Fe(CO)5,分子晶体的熔沸点低,含有配位键和共价键,Fe(CO)5与氧气反应生成红棕色氧化物Fe2O3;
(4)化合物BCF2是COCl2,中心原子是C,通过计算价层电子对数判断空间构型、C的杂化类型、具有相同空间构型的含氧酸根离子;
(5)Mg2+处于8个顶点和6个面心,根据均摊法计算晶胞中Mg原子、O原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算该晶体的体积.
解答 解:(1)Fe原子核外电子数为26,核外电子排布式为1s22s22p63s23p63d64s2;Na的最外层电子排布为3s1,而Mg的最外层电子排布为3s2,达到全满状态,所以Mg的第一电离能较大,
故答案为:1s22s22p63s23p63d64s2;<;
(2)H2O的σ键电子对数为2,孤电子对数为$\frac{1}{2}×$(6-2×1)=2,空间结构为V形,所以键角接近109°28ˊ,但小于109°28ˊ,
故答案为:D;
(3)该晶体熔沸点较低,属于分子晶体,该化合物是Fe(CO)5,中心原子与配体之间形成的是配位键,配体中含有共价键,Fe(CO)5与氧气反应生成红棕色氧化物Fe2O3,化学方程式为4Fe(CO)3+13O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+20CO2,
故答案为:分子; 配位键、共价键;4Fe(CO)3+13O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+20CO2;
(4)化合物BCF2是COCl2,中心原子是C,σ键电子对数为3,孤电子对数为$\frac{1}{2}×$(4-2×1-1×2)=0,COCl2所以是平面三角形结构,C采取sp2杂化,NO3-或CO32-等σ键电子对数为3,孤电子对数为0,和COCl2具有相同空间构型,
故答案为:平面三角形; sp2;NO3-或CO32-等;
(5)Mg2+处于8个顶点和6个面心,因此每个晶胞中含有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,O原子数目=1+12×$\frac{1}{4}$=4,
1个晶胞的体积V=$\frac{40g×4}{{N}_{A}×dg•cm{\;}^{-3}}$=$\frac{160}{{N}_{A}d}$cm3=$\frac{160}{{N}_{A}d}$×1021nm3,
V=a3=$\frac{160}{{N}_{A}d}$×1021nm3,所以a=$\root{3}{\frac{160×1{0}^{21}}{{N}_{A}d}}$nm,
故答案为:4;$\root{3}{\frac{160×1{0}^{21}}{{N}_{A}d}}$.
点评 本题考查晶胞计算,为高频考点,涉及元素周期表、核外电子排布、电离能、晶体类型与性质、空间构型判断等,注意同周期主族元素中第一电离能异常情况,需要学生具备扎实的基础.把握物质结构与性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
(1)m=6.88g;c(NaOH)=5.00mol•L-1.
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为1:2.
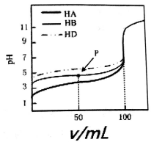
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
| A. | 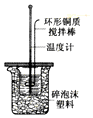 中和反应反应热的测得 | B. | 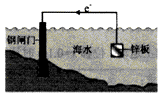 牺牲阳极的阴极保护法 | ||
| C. | 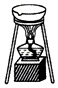 灼烧胆矾晶体测结晶水含量 | D. | 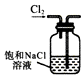 除去Cl2中混有的HCl气体 |
| A. | 乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色 | |
| B. | 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应 | |
| C. | 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH | |
| D. | 有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有5种 |
| A. | 丙烯酸H2C═CHCOOH | B. | 乳酸CH3CH(OH)COOH | ||
| C. | 甘氨酸NH2CH2COOH | D. | 丙酸CH3CH2COOH |
 某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.
某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.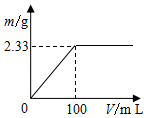 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.