题目内容
8.表是25℃时某些盐的溶度积常数或弱酸的电离平衡常数:下列说法正确的是( )| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 向浓度均为1×10-4 mol/L的KCl和K2CrO4混合液中逐滴加入1×10-3 mol/LAgNO3溶液,CrO42-先沉淀(10-5 mol/L是否太小?这个浓度一般都认为沉淀完全了) | |
| B. | H2CO3、HCO3-、CH3COO-、ClO-在溶液中可以大量共存 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液,各离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+) | |
| D. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+HClO |
分析 A.混合溶液中生成氯化银需要的c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,生成Ag2CrO4需要的c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{O}_{4}^{2-})}}$,需要的银离子浓度小的物质先沉淀;
B.碳酸Ka1大于HClO的Ka,所以碳酸的酸性强于次氯酸,则H2CO3和ClO-在溶液中不能大量共存;
C.弱电解质的电离平衡常数越小,说明该弱电解质的电离程度越小,则其相应离子的水解程度越大;
D.弱电解质的电离平衡常数越大,其酸性越强,所以次氯酸比碳酸氢根离子的酸性强.
解答 解:A.混合溶液中生成氯化银需要的c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-4}}$=1.8×10-6mol/L,生成Ag2CrO4需要的c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{O}_{4}^{2-})}}$=$\sqrt{\frac{2.0×1{0}^{-12}}{1×1{0}^{-4}}}$mol/L=1.4×10-4mol/L,所以氯化银先沉淀,故A错误;
B.碳酸Ka1大于HClO的Ka,所以碳酸的酸性强于次氯酸,则H2CO3和ClO-在溶液中不能大量共存,故B错误;
C.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-),故C正确;
D.HClO的电离平衡常数大于HCO3-,所以次氯酸的酸性大于碳酸氢根离子,向Na2CO3溶液中滴加少量氯水,溶液中碳酸钠过量,盐酸和碳酸钠反应生成碳酸氢钠,次氯酸和碳酸钠反应生成碳酸氢钠和次氯酸钠,反应的离子方程式应为:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-,故D错误;
故选C.
点评 本题考查弱电解质的电离、难溶电解质的溶解平衡,明确弱酸的电离平衡常数越大其酸性越强,则弱酸根离子的水解程度越小,注意ClO-、CO32-、HCO3-的水解程度大小顺序是CO32->ClO->HCO3-,难度较大.

| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
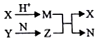 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N<M | B. | .简单离子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | .图中有两个氧化还原反应 |
| A. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| B. | 为防止食品氧化,常在食品袋中放入装有CaO的透气小袋 | |
| C. | 油脂在人体内水解为氨基酸和甘油等小分子被吸收 | |
| D. | 生产有机玻璃的主要原料为纯碱、石英和石灰石 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
(1)m=6.88g;c(NaOH)=5.00mol•L-1.
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为1:2.
| A. | 乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色 | |
| B. | 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应 | |
| C. | 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH | |
| D. | 有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有5种 |
 某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.
某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.