题目内容
5.用以下方法检验或鉴别物质:①用水鉴别NaOH和NaCl固体;②用稀盐酸鉴别NaAlO2和AlCl3溶液;③用澄清石灰水鉴别NaHCO3和Na2CO3溶液;④用湿润的KI-淀粉试纸区分NO2和Br2;⑤用AgNO3溶液检验Cl2中是否混有HCl气体;⑥用淀粉溶液检验碘盐中是否含碘元素.其中能成功的有( )| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①NaOH溶解放热、NaCl固体溶解没有明显热效应;
②二者与盐酸反应先生成白色沉淀,后沉淀溶解的是偏铝酸钠,无现象的是氯化铝;
③Na2CO3溶液和NaHCO3溶液均与石灰水反应生成白色沉淀;
④NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,遇淀粉变蓝;
⑤Cl2溶于水生成HCl;
⑥碘盐中为碘酸钾,遇到淀粉不变色.
解答 解:①NaOH溶解放热、NaCl固体溶解没有明显热效应,把二者分别溶于水,根据溶液的温度变化可以鉴别,故正确;
②NaAlO2溶液中滴加盐酸,一开始生成氢氧化铝沉淀,当盐酸过量时,沉淀又溶解,AlCl3溶液与盐酸不反应,所以能用稀盐酸鉴别NaAlO2和AlCl3溶液,故正确;
③Na2CO3溶液和NaHCO3溶液均与石灰水反应生成碳酸钙,即二者溶液中分别加石灰水,都会形成白色沉淀,现象相同,不能鉴别,故错误;
④NO2与水反应生成硝酸,硝酸能把KI氧化为单质碘,Br2蒸气也能氧化KI中的碘离子生成碘单质,单质碘遇淀粉变蓝,所以现象相同,不能鉴别,故错误;
⑤Cl2溶于水生成HCl,HCl与硝酸银反应生成白色沉淀,所以不用AgNO3溶液检验Cl2中是否混有HCl气体,故错误;
⑥碘盐中为碘酸钾,遇到淀粉不变色,则不能用淀粉溶液检验碘盐中是否含碘元素,故错误.
故选B.
点评 本题考查物质的检验,明确物质的性质是解答本题的关键,注意物质性质的差异即可解答,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
13.分子式为C5H10,且分子中含有2个甲基的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.提纯少量含碳酸氢钠杂质的碳酸钠固体所需用的仪器是( )
①试管;②泥三角;③蒸发皿;④试管夹;⑤坩埚;⑥玻璃棒;⑦石棉网;⑧坩埚钳.
①试管;②泥三角;③蒸发皿;④试管夹;⑤坩埚;⑥玻璃棒;⑦石棉网;⑧坩埚钳.
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
11.为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的氮元素全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
试计算:
(1)m=6.88g;c(NaOH)=5.00mol•L-1.
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为1:2.
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
(1)m=6.88g;c(NaOH)=5.00mol•L-1.
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为1:2.
8.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.lmol.L-1的三种酸HA、HB和HD溶液,pH随NaOH溶液体积变化如图.下列说法不正确的是( )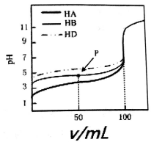

| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
9.下列四种有机物在一定条件下不能作为合成高分子化合物单体的是( )
| A. | 丙烯酸H2C═CHCOOH | B. | 乳酸CH3CH(OH)COOH | ||
| C. | 甘氨酸NH2CH2COOH | D. | 丙酸CH3CH2COOH |
 某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.
某同学利用如图所示实验装置测定常温常压下的气体摩尔体积.