题目内容
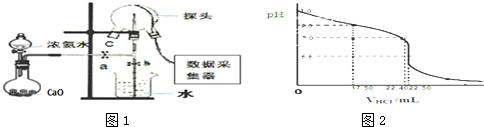
17. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
分析 Ⅰ、(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
Ⅱ、(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测得的热量偏小;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高.
解答 解:Ⅰ、(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.5L×40g/mol=5.0g,故答案为:5.0;
Ⅱ(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)①4次温度差分别为:4.2℃,3.8℃,3.9℃,4.1℃,4组数据都有效,温度差平均值=$\frac{四次实验中(终止温度-初始温度)的和}{4}$=$\frac{4.2°C+3.8°C+3.9°C+4.1°C}{4}$=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376KJ}{0.025mol}$=-53.5 kJ/mol,
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题考查热化学方程式以及反应热的计算,题目难度不大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

| A. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| C. | NH4Cl溶液中:K+、OH-、SO42-、Cl- | |
| D. | pH=1的溶液中:Na+、K+、HCO3-、NO3- |
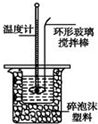
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.【查阅资料】在不同温度下,a-Fe粉末与水蒸气反应的固体产物不同;温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.
【探究一】
(1)甲同学用如左图装置进行a-Fe粉末与水蒸气的反应,湿棉花的作用是提供水蒸气作为反应物;写出该反应的化学方程式:Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
【探究二】
乙同学用如右图装置进行a-Fe粉末与水蒸气反应并验证产物.
(2)实验前必须对整套装置进行的操作是检查气密性;试管a中的物质是水
(3)水槽中的试管里收集的气体是氢气;如果要点燃该气体,必须进行的操作是验纯;
【探究三】乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
【探究反思】
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g.取冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3物质的量,最终确定产物的成分.若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为0.08mol.
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
①需要用硫酸来酸化KMnO4溶液(填字母)A.硫酸 B.盐酸 C.硝酸
褪色所需时间tA<tB(填“>”、“=”或“<”).
②写出该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/LKMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.
当反应中生成的锰离子具有催化作用,所以随后褪色会加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下:
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
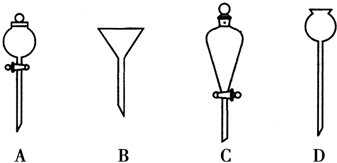
(2)进行分液操作时,使用的漏斗是C(填选项).
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.