题目内容
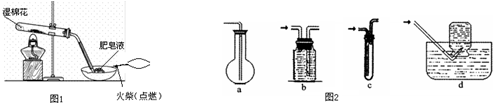
10.某小组欲探究Cl2的化学性质,设计以下反应实验Cl2+KOH+KI→KIOX+KCl+H2O(未配平).Ⅰ[实验方案]实验装置如图
各装置中所使用的试剂如下所示:
A、MnO2 B、饱和食盐水 C、KI、KOH混合溶液 D、AgNO3溶液 E、NaOH溶液 F、浓盐酸
(1)仪器A的名称蒸馏烧瓶,E装置的作用是吸收多余氯气,防止污染空气.
(2)当D装置中出现浑浊(或有白色沉淀) 时,停止加热.
(3)应用平衡原理解释B装置的作用氯气在水中的溶解平衡为:Cl2+H2O?H++Cl-+HClO,饱和食盐水中C(CI-)很大,可以抑制氯气的溶解,而氯化氢又极易溶于水,因此采用饱和食盐水既能除去HCI又能避免因溶解而造成CI2的损失.
Ⅱ[检验产物]
①精确取C中液体20.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸
②向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.5000mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液25.20mL.
已知:原C中KI的浓度为0.1000mol/L;I2+2S2O32-═2I-+S4O62-
(1)写出①的离子反应方程式(2x-1)I-+IOX-+2xH+=xI2+xH2O;
(2)经过计算x=3.15.若与理论值相比偏高,你认为可能的原因是C中有残余氯气,会氧化KI生成I2.若想修正此误差,可采取的方法是加热煮沸所取的20.00mL液体,赶走溶在其中的氯气.
分析 Ⅰ.(1)根据氧气A的构造可知其名称为蒸馏烧瓶;装置中有残留氯气,E是吸收过量的气体防止污染环境;
(2)D装置盛放的是硝酸银溶液,用于判断氯气是否过量,当D中有白色沉淀生成时,则氯气已经过量,应该停止加热;
(3)氯气和水反应生成盐酸和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯化氢极易溶于水;
Ⅱ.(1)I-和IOX-在酸性条件下反应生成碘单质,根据化合价变化配平该反应的离子方程式;
(2)根据消耗的硫代硫酸钠的物质的量及反应方程式计算出生成碘单质的物质的量,结合方程式计算出消耗碘酸根离子的物质的量;根据原C溶液中碘化钾的浓度可知生成碘酸根离子浓度,从而得出x;理论上x应该为3,根据计算结果判断偏高还是偏低,并分析造成该结果的原因;通过加热的方法可以刚走装置中氯气.
解答 解:Ⅰ.(1)根据图示可知,A的名称为蒸馏烧瓶,装置中有残留氯气有毒,E中溶液是吸收过量的氯气,防止污染环境,
故答案为:蒸馏烧瓶; 吸收多余氯气,防止污染空气;
(2)当氯气过量时,装置D中硝酸银溶液会变浑浊,所以当D中出现浑浊(或有白色沉淀)时,停止加热,
故答案为:浑浊(或有白色沉淀);
(3)氯气和水反应生成盐酸和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯化氢极易溶于水,平衡原理解释B装置的作用是,氯气在水中的溶解平衡为:Cl2+H2O?H++Cl-+HClO,饱和食盐水中C(CI-)很大,可以抑制氯气的溶解,而氯化氢又极易溶于水,因此采用饱和食盐水既能除去HCI又能避免因溶解而造成CI2的损失,
故答案为:氯气在水中的溶解平衡为:Cl2+H2O?H++Cl-+HClO,饱和食盐水中C(CI-)很大,可以抑制氯气的溶解,而氯化氢又极易溶于水,因此采用饱和食盐水既能除去HCI又能避免因溶解而造成CI2的损失;
Ⅱ.(1)I-和IOX-在酸性条件下反应生成碘单质,IOX-中碘元素的化合价为(2x-1)价,反应后变为0价,化合价变化为(2x-1),碘离子的化合价为-1,反应后变为0价,化合价变化为1,则碘离子的系数为(2x-1),IOX-的系数为1,然后根据质量守恒配平可得:(2x-1)I-+IOX-+2xH+=xI2+xH2O,
故答案为:(2x-1)I-+IOX-+2xH+=xI2+xH2O;
(2)0.5000mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液25.20mL,消耗硫代硫酸钠的物质的量为:0.5000mol/L×0.0252L=0.0126mol,根据反应I2+2S2O32-=2I-+S4O62-可知,消耗碘单质的物质的量为:0.0126mol×$\frac{1}{2}$=0.0063mol,
原C中KI的浓度为0.1000mol/L,根据质量守恒,反应后生成IOX-的浓度也是0.1000mol/L,则20mL该溶液中含有IOX-的物质的量为:0.1000mol/L×0.02L=0.002mol,根据反应:(2x-1)I-+IOX-+2xH+=xI2+xH2O可知0.002molIOX-完全反应生成碘单质的物质的量为:0.002mol×x=0.0063mol,解得:x=3.15;理论上x应该为3,所以比理论值偏高;可能是装置C中有残余氯气,会氧化KI生成I2,导致x偏高,装置C反应后的溶液中含有氯气会影响测定结果,可加热煮沸所取的20.00mL液体,赶走溶在其中的氯气,
故答案为:3.15; C中有残余氯气,会氧化KI生成I2;加热煮沸所取的20.00mL液体,赶走溶在其中的氯气.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验原理为解答关键,试题侧重考查学生的分析、理解能力及逻辑推理能力,注意掌握物质性质实验方案设计与评价原则.

 阅读快车系列答案
阅读快车系列答案| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
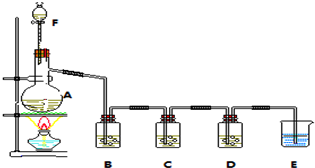
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.【查阅资料】在不同温度下,a-Fe粉末与水蒸气反应的固体产物不同;温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.
【探究一】
(1)甲同学用如左图装置进行a-Fe粉末与水蒸气的反应,湿棉花的作用是提供水蒸气作为反应物;写出该反应的化学方程式:Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
【探究二】
乙同学用如右图装置进行a-Fe粉末与水蒸气反应并验证产物.
(2)实验前必须对整套装置进行的操作是检查气密性;试管a中的物质是水
(3)水槽中的试管里收集的气体是氢气;如果要点燃该气体,必须进行的操作是验纯;
【探究三】乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
【探究反思】
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g.取冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3物质的量,最终确定产物的成分.若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为0.08mol.
①将碱式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,用0.1000mol•L-1标准盐酸润洗2~3次后,再向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点时,记下读数.
④再进行两次滴定,记下读数.
试回答下列问题:
(1)该小组在步骤①中的错误操作是用待测液润洗锥形瓶_,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(2)步骤②中酸式滴定管用标准酸液润洗2~3次的目的是确保标准盐酸溶液的浓度不发生变化.
(3)步骤③中滴定终点如何判断:锥形瓶内溶液由红色变为无色,且半分钟内颜色不再改变.
(4)该小组同学所做三次平行实验的数据记录如下:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)ABDCEF.
(2)上述B步骤操作的目的是除去附在滴定管壁上的水,防止水稀释标准溶液.
(3)实验中用左手控制活塞,眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是溶液的颜色由无色变浅红且保持半分钟内不褪色.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
(5)用0.1000mol•L-1 NaOH溶液滴定0.1000mol•L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH等于10
(6)下列哪些操作会使测定结果偏高B、C、E(填序号).
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶.