题目内容
12.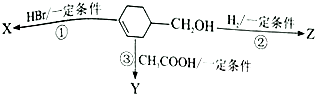 有机物
有机物 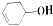 可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )
可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )| A. | 反应③的条件是稀硫酸、加热 | B. | 反应①②的类型不可能相同 | ||
| C. | 有机产物X是一种纯净物 | D. | Y、Z均可使酸性高锰酸钾溶液褪色 |
分析 由图中转化可知,①为碳碳双键与HBr的加成反应或-OH与HBr的取代反应,②为碳碳双键与氢气的加成反应,③为-OH与乙酸的酯化反应,以此来解答.
解答 解:由图中转化可知,①为碳碳双键与HBr的加成反应或-OH与HBr的取代反应,②为碳碳双键与氢气的加成反应,③为-OH与乙酸的酯化反应,
A.酯化反应的条件为浓硫酸、加热,故A错误;
B.由上述分析,①②可能均为加成反应,可能分别为取代、加成反应,故B错误;
C.X可能为加成产物或取代反应,不一定为纯净物,故C错误;
D.Z中含-OH,Y中含碳碳双键,均可使酸性高锰酸钾溶液褪色,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃和醇的性质,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
2.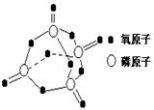 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
3.下列说法正确的是( )
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
2.下列说法不正确的是( )
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |

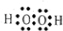
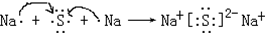
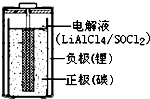 亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃
亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃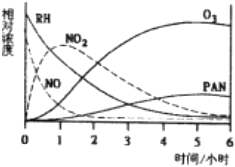
 .
.