题目内容
8.(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示.
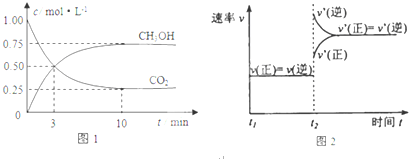
①从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L.min);
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是放热(填“吸”或“放”)反应.
(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2 (g)+CO(g)═CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2 (g)+H2(g)△H=-41.3kJ•mol-1
总合成反应的热化学方程式为2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-205.1kJ•mol-1.
分析 (1)①10min到达平衡,平衡时CH3OH的浓度变化量为0.75mol/L,则氢气浓度变化量为0.75mol/L×3=2.25mol/L,再根据v=$\frac{△c}{△t}$计算;
②由图可知,改变温度正逆反应速率都增大,为升高温度,而升高温度平衡逆向移动,而升高温度平衡向吸热反应方向移动;
(2)已知:①2H2 (g)+CO(g)═CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2 (g)+H2(g)△H=-41.3kJ•mol-1
根据盖斯定律,①×2+②可得:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g).
解答 解:(1)①10min到达平衡,平衡时CH3OH的浓度变化量为0.75mol/L,则氢气浓度变化量为0.75mol/L×3=2.25mol/L,则v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min),
故答案为:0.225mol/(L.min);
②由图可知,改变温度正逆反应速率都增大,为升高温度,而升高温度平衡逆向移动,而升高温度平衡向吸热反应方向移动,故正反应为放热反应,
故答案为:放;
(2)已知:①2H2 (g)+CO(g)═CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2 (g)+H2(g)△H=-41.3kJ•mol-1
根据盖斯定律,①×2+②可得:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g),则△H=2×(-90.8kJ•mol-1)-23.5kJ•mol-1=-205.1kJ•mol-1,
热化学方程式为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-205.1kJ•mol-1,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-205.1kJ•mol-1.
点评 本题考查化学反应速率计算与影响因素、化学平衡影响因素、热化学方程式书写等,难度不大,注意基础知识的理解掌握.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | NaOH溶液的pH小于氨水的pH | B. | NaOH溶液的pH大于氨水的pH | ||
| C. | 两溶液的pH相等 | D. | 无法判别两溶液pH的相对大小 |
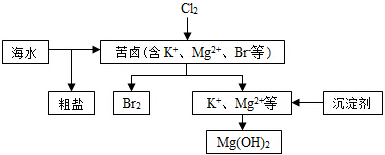
| A. | 向苦卤中通入Cl2,目的是为了提取溴 | |
| B. | 除去粗盐中的SO42-杂质,可以选择BaCl2等试剂 | |
| C. | 工业生产常选用Ca(OH)2作为沉淀剂 | |
| D. | 电解法制取金属镁时,原料一般是灼烧Mg (OH)2得到的MgO |
| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: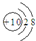 | |
| C. | 质量数为127的钡原子:127Ba | |
| D. | 硫酸的电离方程式:H2SO4═2H+SO${\;}_{4}^{2-}$ |
| A. | 皮肤上沾了少量苯酚,先用稀NaOH溶液洗,再用水冲洗 | |
| B. | 做完银镜反应的试管,应该用稀硫酸清洗 | |
| C. | 试管中残留的苯酚,先用稀NaOH溶液洗,再用水冲洗 | |
| D. | 粘有酚醛树脂的试管,可先用水浸泡几分钟,软化,再清洗 |
| A. | CaCO3--红棕色 | B. | BaSO4--灰绿色 | C. | Al(OH)3--白色 | D. | AgCl--蓝色 |
①聚丙烯酸甲酯
②硝酸纤维
③蛋白质
④醋酸纤维
⑤硬脂酸钠
⑥牛油.
| A. | ②④⑥ | B. | ③⑤ | C. | ②③④⑤ | D. | ①③⑤ |
| A. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |