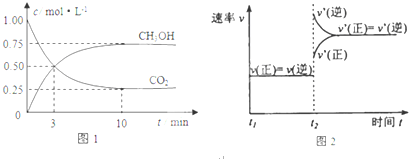
题目内容
20.一定温度下,取pH=12的NaOH溶液和氨水各10mL,分别用蒸馏水冲稀至1L.关于稀释后的溶液的pH的说法正确的是( )| A. | NaOH溶液的pH小于氨水的pH | B. | NaOH溶液的pH大于氨水的pH | ||
| C. | 两溶液的pH相等 | D. | 无法判别两溶液pH的相对大小 |
分析 一水合氨是弱电解质,溶液中存在电离平衡,加水稀释后一水合氨的电离程度增大,溶液中氢氧根离子物质的量增大;氢氧化钠为强电解质,溶液中完全电离,加水稀释后氢氧根离子物质的量基本不变.
解答 解:一水合氨是弱电解质,溶液中存在电离平衡,加水稀释后一水合氨的电离程度增大,溶液中氢氧根离子物质的量增大;氢氧化钠为强电解质,溶液中完全电离,加水稀释后氢氧根离子物质的量基本不变,所以加水稀释后,氨水中氢氧根离子浓度大,即氨水的pH的大,故A正确.
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,根据氢氧化钠和一水合氨电离程度来分析解答即可,难度不大.

练习册系列答案
相关题目
10.为鉴别K2CO3和NaHCO3两种白色固体,下列4种方法中不可行的是( )
| A. | 分别取样配成溶液,滴加CaCl2溶液,观察有无白色沉淀 | |
| B. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
11.在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A. | Cl2+H2O?H++Cl-+HClO | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | H2S?H++HS- | D. | NH4++2H2O?NH3•H2O+H3O+ |
8.Li-Al/FeS电池是一种正在开发的车载电池,该电池正极的反应式为:2Li++FeS+2e-=Li2S+Fe 有关该电池的下列说法中,错误的是( )
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
15.下列说法不正确的是( )
| A. | Al2O3的熔点高,可用作耐火材料 | |
| B. | NaHCO3与盐酸反应,可用于治疗胃酸过多 | |
| C. | SO2可污染环境,不可用于杀菌、消毒 | |
| D. | 二氧化氮、氨气、氯气和二氧化硫都是易液化的气体 |
5.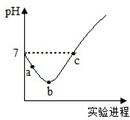 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
12.已知硝酸钾的溶解度随温度的升高而增大,下列叙述正确的是( )
| A. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均增大 | |
| B. | 把60℃的硝酸钾饱和溶液降温到30℃,溶液仍饱和,溶液的质量分数和物质的量浓度均不变 | |
| C. | 60℃硝酸钾饱和溶液中含有的溶质的质量比30℃的硝酸钾饱和溶液中多 | |
| D. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均不变 |