题目内容
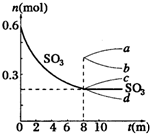 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:(1)写出该反应的平衡常数表达式:
(2)用O2表示从0~8min内该反应的平均速率v=
(3)升高温度,K值将
(4)能说明该反应已达到平衡状态的是
a.v(SO3)=2v(O2)
b.容器内压强保持不变
c.v(SO2)=2v正(O2)
d.容器内密度保持不变
(5)能使该反应的反应速率增大,且平衡向逆反应方向移动的是
a.减少SO3气体的浓度
b.适当升高温度
c.体积不变,增大压强
d.选择高效催化剂
(6)从8min起,压缩容器为1L,则SO3的变化曲线为
A.a B.b C.c D.d.
考点:化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)根据平衡常数的概念;
(2)根据v=
=
求出v(SO3),再利用速率之比等于化学计量数之比,计算v(O2);
(3)根据温度对反应速率、化学平衡的影响分析;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(5)据影响化学反应速率和影响平衡移动的因素角度综合考虑;
(6)根据压强对化学平衡的影响分析.
(2)根据v=
| △c |
| △t |
| ||
| △t |
(3)根据温度对反应速率、化学平衡的影响分析;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(5)据影响化学反应速率和影响平衡移动的因素角度综合考虑;
(6)根据压强对化学平衡的影响分析.
解答:
解:(1)该反应的平衡常数表达式为K=
,故答案为:K=
;
(2)根据v=
=
=0.025mol/(L?min),速率之比等于化学计量数之比,所以有:v(O2)=
v(SO2)=0.0125mol/(L?min),
故答案为:0.0125mol/(L?min);
(3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;减小;
(4)a、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故c正确;
d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(5)a、减少SO3气体的浓度,反应速率减慢,故错误;
b、升温平衡正向移动,故错误;
c、增大压强,反应速率加快,平衡逆向移动,故正确;
d、催化剂不影响平衡移动,故错误;
故选c;
(6)容器的体积减小,压强增大,平衡向逆反应方向移动,SO3的物质的量增多,故答案为:c.
| [SO2]2?[O2] |
| [SO3]2 |
| [SO2]2?[O2] |
| [SO3]2 |
(2)根据v=
| ||
| △t |
| ||
| 8min |
| 1 |
| 2 |
故答案为:0.0125mol/(L?min);
(3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;减小;
(4)a、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故c正确;
d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(5)a、减少SO3气体的浓度,反应速率减慢,故错误;
b、升温平衡正向移动,故错误;
c、增大压强,反应速率加快,平衡逆向移动,故正确;
d、催化剂不影响平衡移动,故错误;
故选c;
(6)容器的体积减小,压强增大,平衡向逆反应方向移动,SO3的物质的量增多,故答案为:c.
点评:本题主要考查平衡常数、反应速率、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
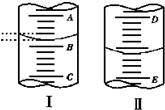 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是4,则两处液面的读数是( )| A、Ⅰ中是3.2 mL,Ⅱ中是3.40 mL |
| B、Ⅰ中是4.8 mL,Ⅱ中是3.40 mL |
| C、Ⅰ中是3.2 mL,Ⅱ中是4.60 mL |
| D、Ⅰ中是4.8 mL,Ⅱ中是4.60 mL |
现将0.5mo1Cu2S与72克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、C(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终反应所得NO物质的量为( )
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol铁,充分反应后产生的NO气体在标准状况下的体积为( )
| A、36L | B、22.4L |
| C、28L | D、11.2L |
下列关于氯水的叙述,正确的是( )
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
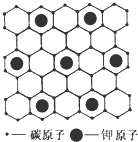 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )