题目内容
现将0.5mo1Cu2S与72克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、C(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终反应所得NO物质的量为( )
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
考点:氧化还原反应的计算
专题:
分析:反应中Cu元素化合价由+1价升高为+2价,S元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒计算生成NO的物质的量.
解答:
解:72克FeO的物质的量为
=1mol,反应中Cu元素化合价由+1价升高为+2价,S元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒:
(5-2)×n(NO)=0.5mol×[2×(2-1)+6-(-2)]+1mol×(3-2)
解得n(NO)=2mol,
故选D.
| 72g |
| 72g/mol |
(5-2)×n(NO)=0.5mol×[2×(2-1)+6-(-2)]+1mol×(3-2)
解得n(NO)=2mol,
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
某温度下,将1molNH3充入恒容密闭容器A中,当反应达到平衡时,NH3的体积分数为x%.在相同条件下,向该容器充入2molNH3,当反应达到平衡时,NH3的体积分数为y%,则x、y大小关系为是( )
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同组同压下产生的气体的体积比是( )
| A、3:1:1 |
| B、6:3:2 |
| C、1:2:3 |
| D、1:1:1 |
下列分子的VSEPR模型与分子立体结构模型一致的是( )
| A、NH3 |
| B、CCl4 |
| C、H2O |
| D、PCl3 |
下列实验仪器不能用于混合物分离提纯的是( )
| A、漏斗 | B、蒸馏烧瓶 |
| C、容量瓶 | D、分液漏斗 |
下列各组中的离子,在同一溶液中不能同时大量共存的是( )
| A、K+、Al3+、SO42-、OH- |
| B、Na+、Cu2+、Cl-、SO42- |
| C、SO42-、H+、Cl-、Na+ |
| D、K+、Mg2+、CO32-、NO3- |
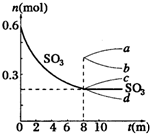 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示: