题目内容
某同学欲用中和滴定的方法来测定某品牌的食用醋中的醋酸的物质的量浓度.实验具体步骤如下:①配制500mL浓度约为0.1mol?L-1的NaOH溶液;②用物质X的标准溶液准确测定该NaOH溶液的浓度(X与氢氧化钠按物质的量比1:1完全反应);③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤 (填“可行”或“不可行”).
(2)称量时,因为NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅该食用醋的包装说明如下:醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol?L-1(已知醋酸的相对分子质量为60)
(4)滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是 .
(5)某同学在实验前,将锥形瓶进行了清洗后,水未倒尽,则造成滴定结果会 (偏大、偏小或无影响)
(6)滴定时边滴边摇动锥形瓶,眼睛应重点观察 .
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
(7)滴定过程中,所发生的离子反应方程式为
(8)若实验过程如下:准确量取该食用醋20.00mL,置于250mL锥形瓶中,再滴加酚酞指示剂,滴定达到终点时,酚酞指示剂由 色变成 色且30秒内不变色即为终点.重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol?L-1).该食用醋中醋酸的物质的量浓度= mol?L-1.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤
(2)称量时,因为NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期
(3)查阅该食用醋的包装说明如下:醋酸含量约为6g/100mL,换算成物质的量浓度约为
(4)滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是
(5)某同学在实验前,将锥形瓶进行了清洗后,水未倒尽,则造成滴定结果会
(6)滴定时边滴边摇动锥形瓶,眼睛应重点观察
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
(7)滴定过程中,所发生的离子反应方程式为
(8)若实验过程如下:准确量取该食用醋20.00mL,置于250mL锥形瓶中,再滴加酚酞指示剂,滴定达到终点时,酚酞指示剂由
考点:中和滴定
专题:实验题
分析:(1)根据配制的是浓度约为0.1mol?L-1的NaOH溶液来判断;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,来分析浓度;
(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c=
来计算;
(4)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出;
(5)根据c(待测)=
,分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)滴定时眼睛应注意注意观察颜色变化,以确定终点;
(7)根据化学方程式、离子方程式的书写原则来解答;
(8)根据酚酞的变色范围确定滴定终点时颜色变化;根据达滴定终点时,依据关系式:CH3COOH~NaOH来计算.
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,来分析浓度;
(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c=
| n |
| V |
(4)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出;
(5)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
(6)滴定时眼睛应注意注意观察颜色变化,以确定终点;
(7)根据化学方程式、离子方程式的书写原则来解答;
(8)根据酚酞的变色范围确定滴定终点时颜色变化;根据达滴定终点时,依据关系式:CH3COOH~NaOH来计算.
解答:
解:(1)由于配制的是浓度约为0.1mol?L-1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的,故答案为:可行;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;
(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n=
=
=0.1mol,醋酸的物质的量浓度C=
=
=1mol/L,故答案为:1;
(4)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出,具体操作是在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次,
故答案为:在碱式滴定管中加入少量标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次;
(5)某同学在实验前,将锥形瓶进行了清洗后,水未倒尽,所取待测液的物质的量没变,故不影响V(标准),所以滴定结果不变,故答案为:无影响;
(6)滴定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点,故答案为:B;
(7)滴定过程中,所发生的化学方程式为:CH3COOH+NaOH=CH3COONa+H2O,离子方程式为:CH3COOH+OH-=CH3COO-+H2O;故答案为:CH3COOH+OH-=CH3COO-+H2O;
(8)待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红);
设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,
CH3COOH~NaOH
1 1
Xmol/L×20.00×10-3L c mol?L-1×V×10-3L
解得X=
mol/L,
故答案为:无;浅红;
.
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;
(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n=
| m |
| M |
| 6g |
| 60g/mol |
| n |
| V |
| 0.1mol |
| 0.1L |
(4)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出,具体操作是在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次,
故答案为:在碱式滴定管中加入少量标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次;
(5)某同学在实验前,将锥形瓶进行了清洗后,水未倒尽,所取待测液的物质的量没变,故不影响V(标准),所以滴定结果不变,故答案为:无影响;
(6)滴定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点,故答案为:B;
(7)滴定过程中,所发生的化学方程式为:CH3COOH+NaOH=CH3COONa+H2O,离子方程式为:CH3COOH+OH-=CH3COO-+H2O;故答案为:CH3COOH+OH-=CH3COO-+H2O;
(8)待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红);
设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,
CH3COOH~NaOH
1 1
Xmol/L×20.00×10-3L c mol?L-1×V×10-3L
解得X=
| cV |
| 20 |
故答案为:无;浅红;
| cV |
| 20 |
点评:本题考查物质的含量的测定,侧重于中和滴定的考查,注重于学生实验能力和分析能力和计算能力的综合考查,为考试高频考点,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列有关实验的说法正确的是( )
| A、中和滴定时,用待测溶液润洗锥形瓶 |
| B、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
| C、用酸式滴定管量取12.00 mL高锰酸钾溶液 |
| D、在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
某温度下,将1molNH3充入恒容密闭容器A中,当反应达到平衡时,NH3的体积分数为x%.在相同条件下,向该容器充入2molNH3,当反应达到平衡时,NH3的体积分数为y%,则x、y大小关系为是( )
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
下列分子的VSEPR模型与分子立体结构模型一致的是( )
| A、NH3 |
| B、CCl4 |
| C、H2O |
| D、PCl3 |
在0.1mol?L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+.对于该平衡,下列叙述正确的是( )
| A、加入水时,CH3COOH的电离程度增大 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量 HCl气体,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
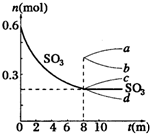 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示:
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2+O2△H>0,其中SO3的变化如图示: