题目内容
有原子量均大于10的A、B两种元素,它们之间可形成化合物X和Y.已知等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3:4.4,经测定X的组成为AB,Y的组成为A2B.试通过计算确定:
A为 ;(填元素符号)B为 (填元素名称).
A为
考点:有机物实验式和分子式的确定
专题:有机化学基础
分析:等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3:4.4,则X、Y相对分子质量之比为3:4.4,即M(X):M(Y)=3:4.4,
=2×8.5,解方程组求得X、Y的相对分子质量,在根据X、Y的组成和相对分子质量计算A、B的相对原子质量,进而确定元素.
| M(X)+M(Y) |
| 2 |
解答:
解:等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3:4.4,则X、Y相对分子质量之比为3:4.4,即M(X):M(Y)=3:4.4,
=2×8.5,联立方程
解得:
即
,解得:
,A是氮 B是氧 X为NO,Y为N2O,
故答案为:N;氧元素.
| M(X)+M(Y) |
| 2 |
|
|
即
|
|
故答案为:N;氧元素.
点评:本题考察了元素的推断,中等难度,关键是根据密度比和质量比列出等式关系.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
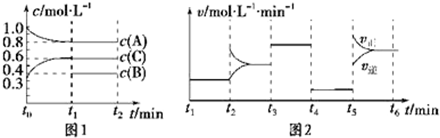
25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A、将水加热到90℃,pH不变 |
| B、向水中加入CH3COONa固体,pH变小 |
| C、向水中加入稀氨水,KW变大 |
| D、向水中加入少量固体硫酸氢钠,KW不变 |
下列说法不正确的是( )
| A、检验Cl-的试剂是硝酸银和稀硝酸 |
| B、检验SO42-的试剂是氯化钡和稀盐酸 |
| C、向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO42- |
| D、某溶液中滴加用盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
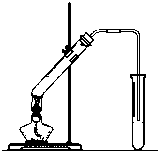 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: