题目内容
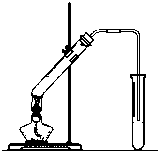 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)①图中左试管中为乙醇、乙酸和浓硫酸的混合液,其中浓硫酸的作用是
②把制得的把乙酸乙酯分离出,此过程中应采用的实验操作是
(2)写出制取乙酸乙酯的化学方程式
(3)对是否饮酒后驾车的检测有多种方法,其中有一种化学方法是:让司机呼出的气体接触载有经过硫酸酸化处理的三氧化铬的硅胶,若气体中有乙醇(酒精),则发生反应:3C2H5OH+2CrO3 (桔黄色)+3H2SO4→3CH3CHO+Cr2(SO4)3 (蓝绿色)+6H2O使检测仪变色从而得知司机是否饮酒,则下列说法正确的是
A.C2H5OH在反应中被氧化
B.CrO3变为Cr2(SO4)3发生了氧化反应
C.CH3CHO的氧化性强于CrO3
D.在检测中,每有1mol乙醇反应,就有3mol电子转移.
考点:乙酸乙酯的制取
专题:有机物的化学性质及推断
分析:(1)①浓硫酸起到了催化作用和吸水作用,根据乙酸乙酯中混有的乙酸、乙醇易溶于水,导管伸入液面下可能发生倒吸分析;
②分离互不相溶的液体,可用分液的方法分离,分液用到的主要玻璃仪器是分液漏斗,乙酸乙酯的密度小于水,因此分层后乙酸乙酯在上层;
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)A.C2H5OH在反应中失去了H,发生氧化反应,被氧化;
B.CrO3变为Cr2(SO4)3,Cr化合物降低,发生了还原反应;
C.氧化剂的氧化性大于氧化产物的氧化性,是CrO3氧化剂,CH3CHO是氧化产物;
D.C2H5OH→CH3CHO,C的化合价由-4→-2,每有1mol乙醇反应,反应,失去2mol电子.
②分离互不相溶的液体,可用分液的方法分离,分液用到的主要玻璃仪器是分液漏斗,乙酸乙酯的密度小于水,因此分层后乙酸乙酯在上层;
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)A.C2H5OH在反应中失去了H,发生氧化反应,被氧化;
B.CrO3变为Cr2(SO4)3,Cr化合物降低,发生了还原反应;
C.氧化剂的氧化性大于氧化产物的氧化性,是CrO3氧化剂,CH3CHO是氧化产物;
D.C2H5OH→CH3CHO,C的化合价由-4→-2,每有1mol乙醇反应,反应,失去2mol电子.
解答:
解:(1)①乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂、吸水剂;
乙酸乙酯中混有的乙酸、乙醇易溶于水,导管伸入饱和碳酸钠溶液液面下可能发生倒吸分析,
故答案为:催化剂、吸水剂;倒吸;
②饱和碳酸钠溶液降低乙酸乙酯在水中的溶解度,溶液分层,因此可采取分液操作实现乙酸乙酯的分离,分液用到的主要玻璃仪器是分液漏斗,乙酸乙酯的密度小于水,上层得乙酸乙酯,上层液体从上口倒出,
故答案为:分液;分液漏斗;上口倒出;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为CH3COOH+CH3CH2OH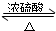 CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH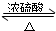 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)A.C2H5OH→CH3CHO,C的化合价由-4→-2,发生氧化反应,被氧化,故A正确;
B.CrO3变为Cr2(SO4)3,Cr化合物降低,发生了还原反应,故B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,是CrO3氧化剂,CH3CHO是氧化产物,因此CH3CHO的氧化性弱于CrO3,故C错误;
D.C2H5OH→CH3CHO,C的化合价由-4→-2,每有1mol乙醇反应,失去2mol电子,故D错误;
故答案为:A.
乙酸乙酯中混有的乙酸、乙醇易溶于水,导管伸入饱和碳酸钠溶液液面下可能发生倒吸分析,
故答案为:催化剂、吸水剂;倒吸;
②饱和碳酸钠溶液降低乙酸乙酯在水中的溶解度,溶液分层,因此可采取分液操作实现乙酸乙酯的分离,分液用到的主要玻璃仪器是分液漏斗,乙酸乙酯的密度小于水,上层得乙酸乙酯,上层液体从上口倒出,
故答案为:分液;分液漏斗;上口倒出;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为CH3COOH+CH3CH2OH
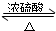 CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH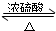 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;(3)A.C2H5OH→CH3CHO,C的化合价由-4→-2,发生氧化反应,被氧化,故A正确;
B.CrO3变为Cr2(SO4)3,Cr化合物降低,发生了还原反应,故B错误;
C.氧化剂的氧化性大于氧化产物的氧化性,是CrO3氧化剂,CH3CHO是氧化产物,因此CH3CHO的氧化性弱于CrO3,故C错误;
D.C2H5OH→CH3CHO,C的化合价由-4→-2,每有1mol乙醇反应,失去2mol电子,故D错误;
故答案为:A.
点评:本题考查乙酸乙酯的制备、氧化还原反应原理,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力,(3)考查氧化还原反应原理是难点.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列各组物质的溶液,不另加试剂无法一一鉴别的是( )
| A、NaOH HCl CuSO4 MgSO4 |
| B、Na2CO3 K2SO4 BaCl2 HCl |
| C、KNO3 HCl CaCl2 NaOH |
| D、NH4NO3 H2SO4 NaOH MgCl2 |
下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
| A、Fe(NO3)3、NaOH、CuSO4、KCl |
| B、KCl、AgNO3、HCl、HNO3 |
| C、CuSO4、NaCl、KNO3、BaCl2 |
| D、BaCl2、Na2SO4、Na2CO3、HCl |
将下列各组物质混合后,溶液中一定有沉淀生成的是( )
| A、Al2(SO4)3溶液与过量氨水 |
| B、NaOH溶液与AlCl3溶液 |
| C、NaAlO2溶液与盐酸 |
| D、少量CO2通入CaCl2溶液 |
 (1)用它作为气体收集装置:若从a端进气可收集的有
(1)用它作为气体收集装置:若从a端进气可收集的有