题目内容
向容积为2L的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出.
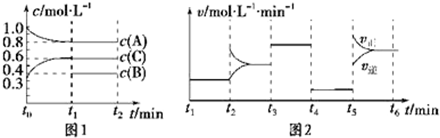
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= .
(2)t4-t5阶段改变的条件为,B的起始物质的量为.各阶段平衡时对应的平衡常数如下表所示:则K1、K2、K3、K4、K5之间的关系为 (用“>”“<”或“=”连接).
(3)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为 .

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=
(2)t4-t5阶段改变的条件为,B的起始物质的量为.各阶段平衡时对应的平衡常数如下表所示:则K1、K2、K3、K4、K5之间的关系为
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
考点:化学平衡的影响因素,反应速率的定量表示方法,等效平衡
专题:化学平衡专题,化学反应速率专题
分析:(1)根据v=
计算v(C);
(2)反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,写出该反应的方程式为2A(g)+B(g?3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,根据平衡常数,平衡移动解答K1、K2、K3、K4、K5之间的关系;
(3)要达到t1时刻同样的平衡,应为完全等效平衡,则折算后与原平衡相等.
| △c |
| △t |
(2)反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,写出该反应的方程式为2A(g)+B(g?3C(g),起始2molA所对应的浓度为1mol/L,则体积应是2L,根据平衡常数,平衡移动解答K1、K2、K3、K4、K5之间的关系;
(3)要达到t1时刻同样的平衡,应为完全等效平衡,则折算后与原平衡相等.
解答:
解:(1)15min内,以C浓度变化表示的反应速率为v(C)=
=0.02 mol/(L?min),
故答案为:0.02 mol/(L?min);
(2)反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g?3C(g),所以,△c(B)=
△n(A)=
×0.2mol/L=0.1mol/L,起始2molA所对应的浓度为1mol/L,则体积应是
=2L,故B的起始物质的量为n(B)=(0.1mol/L+0.4mol/L)×2L=1mol,
t1-t2段,处于平衡状态,c(A)平衡=0.8mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=
=
=0.84,
t2-t3段,为改变浓度,平衡移动,平衡常数不变,K2=0.84,
t3-t4段,使用催化剂,加快反应,平衡常数不变,K3=0.84,
t4-t5段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K4=0.84,
t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,
故 K1=K2=K3=K4<K5,
故答案为:K1=K2=K3=K4<K5;
(3)反应的方程式为2A(g)+B(g)?3C(g),
根据方程式计算,起始时,将C从理论上转化为A、B,
则A的物质的量为2mol+
×0.6mol=2.4mol,B的物质的量为1mol+
×0.6mol=1.2mol,
在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,则所加物质的物质的量必须折算后与原平衡相等.
所以有a+
c=2.4,b+
c=1.2.
故答案为:a+
c=2.4,b+
c=1.2.
| 0.6mol/L-0.3mol/L |
| 15min |
故答案为:0.02 mol/(L?min);
(2)反应物的浓度降低,生成物的浓度增大,结合图一可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应为等体积变化的反应,所以B为反应物,根据化学反应的速率之比等于化学方程式前的计量系数比,
该反应的方程式为2A(g)+B(g?3C(g),所以,△c(B)=
| 1 |
| 2 |
| 1 |
| 2 |
| 2mol |
| 1mol/L |
t1-t2段,处于平衡状态,c(A)平衡=0.8mol/L,c(B)平衡=0.4mol/L,c(C)平衡=0.6mol/L,
K1=
| c3(C) |
| c2(A)?c(B) |
| 0.63 |
| 0.82×0.4 |
t2-t3段,为改变浓度,平衡移动,平衡常数不变,K2=0.84,
t3-t4段,使用催化剂,加快反应,平衡常数不变,K3=0.84,
t4-t5段,为降低压强,反应速率降低,平衡不移动,平衡常数不变,K4=0.84,
t5-t6段,为升高温度,平衡向正反应方向移动,平衡常数增大,
故 K1=K2=K3=K4<K5,
故答案为:K1=K2=K3=K4<K5;
(3)反应的方程式为2A(g)+B(g)?3C(g),
根据方程式计算,起始时,将C从理论上转化为A、B,
则A的物质的量为2mol+
| 2 |
| 3 |
| 1 |
| 3 |
在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,则所加物质的物质的量必须折算后与原平衡相等.
所以有a+
| 2 |
| 3 |
| 1 |
| 3 |
故答案为:a+
| 2 |
| 3 |
| 1 |
| 3 |
点评:本题以图象的形式考查影响化学反应速率以及化学平衡移动的因素,题目难度中等,注意等效平衡问题,为本题的难点,也是易错点.μ

练习册系列答案
相关题目
0.6molH2 与0.4molO2 在标准状况下混合,则混合后的物质的量是 mol,体积是 L,混合气体的平均摩尔质量是 ,H2的质量分数是 .(已知平均摩尔质量等于气体总质量除以气体总的物质的量)
从2012年9月15日开始,全球华人在世界各地爆发保钓游行示威活动,海内外华人,同仇敌忾,强烈谴责日本侵略行为,揭露其侵略本质的真面目,向世界宣示钓鱼岛是中国不可分割的领土.在下列示威活动中属于化学变化的是( )
| A、高呼口号:钓鱼岛,中国的! |
| B、高举鲜艳的五星红旗,齐唱国歌 |
| C、焚烧像征日本军国主义的画像 |
| D、极个别丧失理智的人违法打砸同胞的日系车 |
下列说法中正确的是( )
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32- |
| B、某无色溶液滴加酚酞试液显红色,该溶液不一定是碱 |
| C、某溶液中滴加了BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42- |
| D、验证碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3,有白色沉淀出现证明含有Cl- |
下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
| A、Fe(NO3)3、NaOH、CuSO4、KCl |
| B、KCl、AgNO3、HCl、HNO3 |
| C、CuSO4、NaCl、KNO3、BaCl2 |
| D、BaCl2、Na2SO4、Na2CO3、HCl |
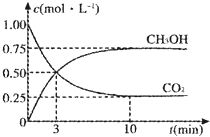 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.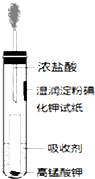 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4