题目内容
(1)下列说法中正确的是 .
A.第一电离能由大到小的顺序为O>N>C
B.由于N2和O22+互为等电子体,所以可以推断O22+的电子式为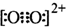
C.根据岩浆晶出规则,CaO比MgO更容易在岩浆冷却过程中先结晶
D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
(2)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol σ键.
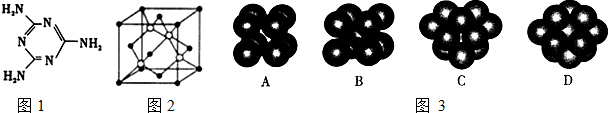
(3)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为 .
(4)碳化硅的晶胞结构(如图2)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图中“●”点构成的堆积方式与下列图3式中 所表示的堆积方式相同.
(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有 个.设晶胞边长为a cm,阿伏加德罗常数用NA表示,则碳化硅晶体的密度为 .
A.第一电离能由大到小的顺序为O>N>C
B.由于N2和O22+互为等电子体,所以可以推断O22+的电子式为
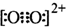
C.根据岩浆晶出规则,CaO比MgO更容易在岩浆冷却过程中先结晶
D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
(2)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是

(3)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为
(4)碳化硅的晶胞结构(如图2)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图中“●”点构成的堆积方式与下列图3式中
(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有
考点:原子核外电子排布,电子式,“等电子原理”的应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)A、同周期从左到右,第一电离能增大,但同周期第ⅡA、ⅤA元素反常;
B、C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体;
C、岩浆晶出规则:晶格能高的晶体熔点较高,更容易在岩浆冷却过程中先结晶;
D、液体HF分子间若形成氢键,有可能发生缔合现象;
(2)根据价层电子对互斥理论确定其杂化方式,根据三聚氰胺和 σ 键的关系式计算;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用;根据ρ=
计算.
B、C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体;
C、岩浆晶出规则:晶格能高的晶体熔点较高,更容易在岩浆冷却过程中先结晶;
D、液体HF分子间若形成氢键,有可能发生缔合现象;
(2)根据价层电子对互斥理论确定其杂化方式,根据三聚氰胺和 σ 键的关系式计算;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用;根据ρ=
| m |
| V |
解答:
解:(1)A、同周期元素从左到右,元素的第一电离能逐渐增大,但N最外层为半充满状态,较稳定,则应为N>O>C,故A错误;
B、C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体,结构相似,故B正确;
C、晶格能越大,形成的离子晶体越稳定,而且熔点越高,Mg0的晶格能大于Ca0,根据岩浆晶出规则,Mg0先结晶,故C错误;
D、液体HF分子间若形成氢键,有可能发生缔合现象,故D正确;
故答案为:BD;
(2)三聚氰胺分子中,氨基上的N原子含有3个 σ 键和一个孤电子对,所以采取sp3杂化,环上的N原子含有2个 σ 键和一个孤电子对,所以采取sp2杂化,一个三聚氰胺分子中含有15个σ 键,所以1mol三聚氰胺分子中 σ 键的数目为15NA;
故答案为:sp2、sp3;15NA;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的M层电子排布式为3s23p63d8;
故答案为:3s23p63d8;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合;
故答案为:D;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用,故与碳原子距离最近且相等的碳原子有12个;
晶胞中C原子数目=8×
+6×
=4,Si原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,ρ=
=
=
g?cm-3.
故答案为:12;
g?cm-3.
B、C22-和O22+两种微粒,原子数相同,价电子总数相等互为等电子体,结构相似,故B正确;
C、晶格能越大,形成的离子晶体越稳定,而且熔点越高,Mg0的晶格能大于Ca0,根据岩浆晶出规则,Mg0先结晶,故C错误;
D、液体HF分子间若形成氢键,有可能发生缔合现象,故D正确;
故答案为:BD;
(2)三聚氰胺分子中,氨基上的N原子含有3个 σ 键和一个孤电子对,所以采取sp3杂化,环上的N原子含有2个 σ 键和一个孤电子对,所以采取sp2杂化,一个三聚氰胺分子中含有15个σ 键,所以1mol三聚氰胺分子中 σ 键的数目为15NA;
故答案为:sp2、sp3;15NA;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的M层电子排布式为3s23p63d8;
故答案为:3s23p63d8;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合;
故答案为:D;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用,故与碳原子距离最近且相等的碳原子有12个;
晶胞中C原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| a3cm3 |
| 160 |
| NA?a3 |
故答案为:12;
| 160 |
| NA?a3 |
点评:本题考查晶胞结构与计算、杂化理论、核外电子排布、等电子原理利用等,需要学生具有良好的空间想象力与计算能力,综合性较强,难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
将下列各组物质混合后,溶液中一定有沉淀生成的是( )
| A、Al2(SO4)3溶液与过量氨水 |
| B、NaOH溶液与AlCl3溶液 |
| C、NaAlO2溶液与盐酸 |
| D、少量CO2通入CaCl2溶液 |
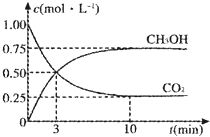 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
 (1)用它作为气体收集装置:若从a端进气可收集的有
(1)用它作为气体收集装置:若从a端进气可收集的有