题目内容
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):
Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 .
(4)写出与CO互为等电子体的离子 .(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 .
Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为
考点:元素电离能、电负性的含义及应用,原子核外电子排布,配合物的成键情况,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;
(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 ,一价铜离子为失去一个电子,核外电子排布为1s22s22p63s23p63d10;
(3)根据化合物的化学式判断,一价铜离子有三个氨基配体和一个羰基配体,共4个配体;
(4)等电子体为核外电子数相同的粒子,羰基为14个电子,其他含有14个电子的都可以;
(5)计算杂化类型时根据电子对数来判断,中心原子的价电子数与配体电子数的和除以2就得到电子对数,根据电子对数,可以确定杂化类型.
(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 ,一价铜离子为失去一个电子,核外电子排布为1s22s22p63s23p63d10;
(3)根据化合物的化学式判断,一价铜离子有三个氨基配体和一个羰基配体,共4个配体;
(4)等电子体为核外电子数相同的粒子,羰基为14个电子,其他含有14个电子的都可以;
(5)计算杂化类型时根据电子对数来判断,中心原子的价电子数与配体电子数的和除以2就得到电子对数,根据电子对数,可以确定杂化类型.
解答:
解:(1)一般来说非金属性越强,第一电离能大,所以O>N>C.但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以O比N容易失去电子,
故答案为:N>C>O;
(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10或[Ar]3d10;
(3)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为:4;
(4)等电子体为核外电子数相同的粒子,羰基为14个电子,如CN-也为14个电子,故答案为:CN-;
(5)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,氮原子形成了3个σ键,同时还有一对孤电子,电子对数为3+1=4,故杂化轨道为sp3.σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,
故答案为:sp2、sp3;7NA.
故答案为:N>C>O;
(2)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10或[Ar]3d10;
(3)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为:4;
(4)等电子体为核外电子数相同的粒子,羰基为14个电子,如CN-也为14个电子,故答案为:CN-;
(5)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,氮原子形成了3个σ键,同时还有一对孤电子,电子对数为3+1=4,故杂化轨道为sp3.σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,
故答案为:sp2、sp3;7NA.
点评:本题考查了第一电离能的大小比较,一价铜离子的核外电子排布为1s22s22p63s23p63d10,根据化合物的化学式判断配体个数,等电子体,杂化类型计算,晶胞中原子个数计算.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列物质属于共价化合物的是( )
| A、Mg | B、HCl |
| C、Si | D、NaCl |
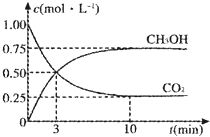 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.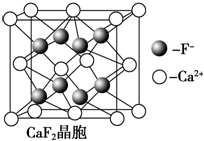
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4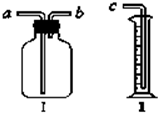 (1)用它作为气体收集装置:若从a端进气可收集的有
(1)用它作为气体收集装置:若从a端进气可收集的有