题目内容
3.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
分析 加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g,可知2.33g沉淀为硫酸钡,则含SO42-为$\frac{2.33g}{233g/mol}$=0.01mol,可知4.88g沉淀为硫酸钡和其它沉淀的混合物,离子浓度均相等,沉淀若为碳酸钡,则含HCO3-,碳酸钡的质量为0.01mol×197g/mol=1.97g<4.88g-2.33g,则沉淀还含为氢氧化镁,则含Mg2+为=$\frac{2.55g-1.97g}{58g/mol}$=0.01mol,结合电荷守恒来解答.
解答 解:加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g,可知2.33g沉淀为硫酸钡,则含SO42-为$\frac{2.33g}{233g/mol}$=0.01mol,可知4.88g沉淀为硫酸钡和其它沉淀的混合物,离子浓度均相等,沉淀若为碳酸钡,则含HCO3-,碳酸钡的质量为0.01mol×197g/mol=1.97g<4.88g-2.33g,则沉淀还含为氢氧化镁,则含Mg2+为=$\frac{2.55g-1.97g}{58g/mol}$=0.01mol,由电荷守恒可知,一定含Na+、K+中的一种,不能确定是否含Cl-,若Na+、K+均存在,则含Cl-,
A.由上述分析可知,一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种,故A正确;
B.加入硝酸酸化的硝酸银溶液,SO42-、Cl-均反应生成白色沉淀,不能检验,故B错误;
C.c(HCO3-)=$\frac{0.01mol}{0.2L}$=0.05mol/L,故C正确;
D.由上述分析可知,4.88g沉淀中含有3种成分,分别为硫酸钡、氢氧化镁、碳酸钡,故D正确;
故选B.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,注意离子浓度相等及电荷守恒的应用,题目难度不大.

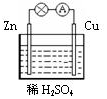
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
(1)制取甲胺的反应为CH3OH(g)+NH3(g)?CH3NH2(g)+H2O(g)△H.已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
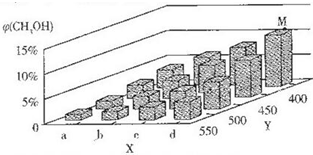
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).某同学认为上图中Y轴表示温度,你认为他判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3mol PbI2的反应中,转移电子的物质的量为2mol
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,则Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=4000
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)?2HI(g) 的△H小于(填大于或小于)0.
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O?3H++HSO4+2I-,I2+I-?I3-,
图2中曲线a、b分别代表的微粒是H+、I3-(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.

| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |
| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |

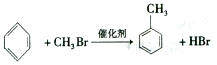 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+
 .
.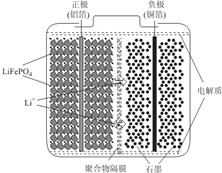 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.