题目内容
6. 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).
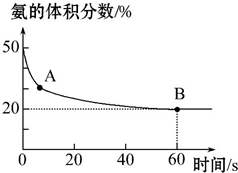
某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体).
A点的正反应速率v正(CO2)大于(填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).
实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
②下列说法能说明上述反应建立化学平衡状态的是CD.
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化
D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=$\frac{1}{(3.2×1{0}^{-3})^{2}×(1.6×1{0}^{-3})}$(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的2倍.
④温度一定时,向上述容器中再按照NH3和CO2物质的量之比为2:1充入一定量的混合气体,平衡向右(填“向左”“向右”或“不”)移动,该平衡中NH3的浓度与原平衡时NH3浓度相比前者大(填“前者大”“后者大”或“相等”).
分析 (1)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应;
反应物是气体,产物是固体,该反应是熵减小的过程;
②反应2NH3(g)+CO2(g)?NH2COONH4(s)达到平衡状态的判断要紧扣平衡状态的特征,同一反应物或生成物表示的正、逆反应速率相等或
反应体系各物质的量不再随时间变化而变化;此反应的特征时生成物为固体,从反应物开始进行时反应物的变化量与起始量的比值相等,始终保持不变,另外混合气体的组份也始终保持不变,即混合气体的平均相对分子质量操持不变,无法确定是否是平衡状态;
③根据平衡三段式计算各物质的平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行列式;结合表格判断每升高10℃
判断平衡常数的变化规律;
④同等比例增大两种反应物的浓度,相当于容器体积减小,促进平衡向气体化学计量数和小的一方移动,根据勒夏特列原理比较NH3的浓度的大小.
解答 解:(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:大于;75%;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故△H<0;
反应物是气体,产物是固体,该反应是熵减小的过程,即,△S<0,故答案为:<;<;
②反应2NH3(g)+CO2(g)?NH2COONH4(s)中,开始加入的NH3与CO2物质的量之比为2:1,而反应消耗的NH3与CO2物质的量之比也是2:1,因此反应的任意时刻二者物质的量之比是2:1,因此浓度之比2:1不能作为平衡的标志.由于NH2COONH4为固体,气体只有NH3和CO2,并且无论是否平衡,二者的物质的量之比不变,则平均相对分子质量不变,所以平均相对分子质量不能作为平衡的标志.随反应的进行,气体质量减小,达到平衡时,质量不再发生变化,反应过程容器体积不变,因此密度可作为平衡的标志,因此C、D符合题意;故答案为:C、D;
③反应NH2COONH4(s)?2NH3(g)+CO2(g),设二氧化碳浓度的变化量x,
2NH3(g)+CO2(g)?NH2COONH4(s).
初始浓度 0 0
变化浓度:2x x
平衡浓度:2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,2x=3.2×10-3mol/L,
K=$\frac{1}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$=$\frac{1}{(3.2×1{0}^{-3})^{2}×(1.6×1{0}^{-3})}$,
根据表中数据分析,反应每升高10℃,则平衡时气体的总浓度就变为原来的2倍,
故答案为:$\frac{1}{(3.2×1{0}^{-3})^{2}×(1.6×1{0}^{-3})}$;2;
④在恒温、恒容条件下,同等比例增加反应物的量,相当于减小容器体积,增大压强平衡正向移动,但根据勒夏特列原理,重新平衡时NH3的浓度比原平衡时NH3浓度大,故答案为:向右;前者大.
点评 本题考查化学反应速率、化学平衡的移动原理、平衡常数的计算、勒夏特列原理应用等知识,易错点是化学平衡常数的计算及判断两个不同平衡状态下NH3的浓度,综合性较大,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| D. | 亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
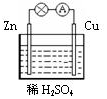
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
(1)制取甲胺的反应为CH3OH(g)+NH3(g)?CH3NH2(g)+H2O(g)△H.已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
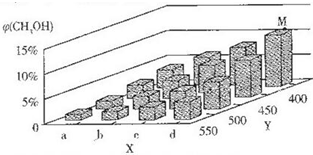
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).某同学认为上图中Y轴表示温度,你认为他判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3mol PbI2的反应中,转移电子的物质的量为2mol
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,则Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=4000
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)?2HI(g) 的△H小于(填大于或小于)0.
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O?3H++HSO4+2I-,I2+I-?I3-,
图2中曲线a、b分别代表的微粒是H+、I3-(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.
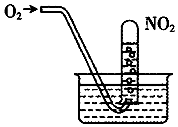
| A. | 当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3 | |
| B. | 当试管气体不是红棕色时,说明NO2全部转化为HNO3 | |
| C. | 水槽内的水改为稀盐酸,有利于吸收NO2 | |
| D. | 水槽内的水改为稀NaOH溶液,有利于吸收NO2 |
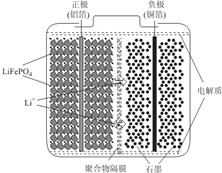 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.