题目内容
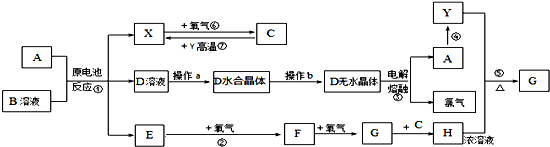
20. 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是铁屑,A中反应的离子方程式是:Fe+2H+=Fe2++H2↑.
(2)实验开始时就先将活塞E打开(填“打开”或“关闭”),C中收集到气体的主要成分是H2.
(3)简述生成Fe(OH)2的操作过程关闭活塞E,使FeSO4溶液压入B瓶中进行反应.
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 制取氢氧化亚铁使用的试剂是硫酸亚铁和氢氧化钠溶液,但是一定要注意隔绝氧气的氧化,所以B装置中是氢氧化钠,A是产生硫酸亚铁的装置,保证其进入B中,要借助氢气产生的压强,根据实验试剂以及原理来回答分析即可.
(1)制取硫酸亚铁需要铁屑,所以在烧瓶中应该先加入铁屑;
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,该反应中有气体生成,应先将活塞E打开,使气体进入B和C装置中,所以C中收集的气体主要是氢气;
(3)关闭活塞E,利用气体压强使FeSO4溶液被压入B瓶中进行反应;
(4)氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁.
解答 解:(1)B中盛一定量的NaOH溶液,则A中必须提供亚铁离子,所以应预先加入的试剂是铁粉,A中反应的离子方程式是Fe+2H+=Fe2++H2↑,
故答案为:铁屑;Fe+2H+=Fe2++H2↑;
(2)为防止生成的氢氧化亚铁被氧化,则需要利用稀硫酸和铁反应产生的氢气排尽装置中的空气,如果不打开活塞E,会造成安全事故,所以要打开活塞E,使生成的气体进入装置B和C,一方面能除去A和B装置中的空气,另一方面能防止安全事故的发生,C装置中收集的气体主要是氢气,
故答案为:打开;H2;
(3)铁和硫酸反应有氢气生成,关闭活塞E,导致A装置中氧气增大使FeSO4溶液被压入B瓶中进行反应生成氢氧化亚铁,
故答案为:关闭活塞E,使FeSO4溶液压入B瓶中进行反应;
(4)氢氧化亚铁不稳定,容易被空气中的氧气氧化生成红褐色的氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了氢氧化亚铁的制取,难度不大,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点.


| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH3CH2CH2OH和CH3-O-CH2CH3 | B. |  | ||
| C. |  和CH3(CH2)2CHO 和CH3(CH2)2CHO | D. |  |
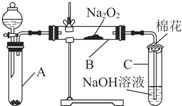 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+═BaSO4 | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硝酸汞溶液与铝反应:Hg2++Al3+═Al3++Hg |