题目内容
8.用如图所示装置进行实验.将少量液体逐滴加入到的固体乙中,试管中试剂为丙,则下表中现象正确的是( )
| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al(OH)3易溶于强碱但难溶于弱碱溶液;
B.二氧化氮呈红棕色且具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色;
C.二氧化锰和浓盐酸制取氯气需要加热;
D.氧气具有氧化性,能氧化氢硫酸生成S单质.
解答 解:A.浓氨水和生石灰混合,CaO和水反应放出的热量导致一水合氨分解生成氨气,氨气极易溶于水生成一水合氨,一水合氨能Al(SO4)3发生复分解反应,Al(OH)3易溶于强碱但难溶于弱碱氨水溶液,所以试管中生成白色沉淀但沉淀不溶解,故A错误;
B.铜和浓硝酸反应生成红棕色气体二氧化氮,二氧化氮具有强氧化性,能和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,所以丙中溶液呈蓝色,故B错误;
C.二氧化锰和浓盐酸制取氯气需要加热,该实验没有加热,所以没有氯气生成,故C错误;
D.氧气具有氧化性,能氧化氢硫酸生成S单质,所以丙中产生淡黄色沉淀,溶液出现浑浊,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及气体制取、氧化还原反应、物质性质等知识点,明确实验原理及物质性质是解本题关键,注意氢氧化铝的两性及二氧化氮的强氧化性,易错选项是B.

练习册系列答案
相关题目
18.下列反应中,氧化与还原在同一元素中进行的是( )
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
19.某元素R的最高价氧化物的化学式为R2O5,已知其气态氢化物含氢8.8%,则元素R的相对原子质量为( )
| A. | 14 | B. | 28 | C. | 31 | D. | 35.5 |
3.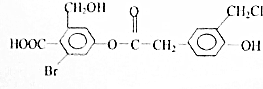 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
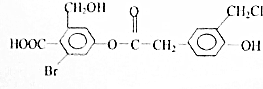 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )| A. | 8:1:7 | B. | 5:1:6 | C. | 5:2:6 | D. | 7:1:6 |
19. (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
a.低温高压 b.加入催化剂 c.体积不变充入氦气
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g),在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,该温度的平衡常数为400.
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.04 mol•L-1•min-1.若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
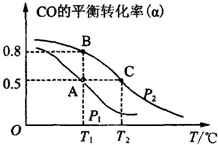
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)═CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2,用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为O2+2H2O+4e-=4OH-.
 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.a.低温高压 b.加入催化剂 c.体积不变充入氦气
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g),在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.04 mol•L-1•min-1.若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)═CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2,用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为O2+2H2O+4e-=4OH-.
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.