题目内容
11.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,Y为黑色固体,常温下C为无色液体,B是一种盐,受热极易分解,在工农业生产中用途较广.现用A与石墨作电极,B的浓溶液作电解质,构成原电池.有关物质之间的转化关系如图(其中有些反应的条件及部分生成物被略去):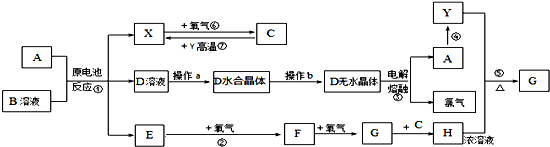
请填写下列空白:
(1)原电池反应①中正极的电极反应式为2NH4++2e-=2NH3↑+H2↑;
(2)反应②的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)“操作b”为在HCl气流中蒸干;
(5)反应⑤的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(6)检验气体E的试剂及现象是湿润的红色石蕊试纸,变蓝;
(7)已知E可与次氯酸钠溶液反应生成K,K和E的组成元素相同,且一分子K中有18个电子,则K中所含的化学键类型为极性共价键、非极性共价键.
分析 C为无色液体,由气体X(X由原电池反应得到,可能是H2)和氧气反应得到,故C应是H2O,X是H2;根据反应⑦可知非金属Y是C;由电解D无水晶体得到A与Cl2,可知D为氯化物且是离子化合物,结合A+B溶液发生原电池反应得到X、D、E,可知B为氯化物,且B是一种盐,受热极易分解,反应生成的H2与E气体,B应水解呈酸性,由转化关系:E→F→G→H,属于常温下气体E的连续氧化得到气体G,在中学阶段中N、S元素化合物符合转化关系,考虑反应①是金属与NH4Cl溶液发生的原电池反应,可推出E为NH3、F为NO、G为NO2,则H为HNO3;(1)中反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,应为Mg与二氧化碳的反应,可推出A为Mg,则D为MgCl2;结合反应①可推知B为NH4Cl,验证符合转化关系,据此进行解答,
(1)原电池反应①中,正极发生还原反应,铵根离子放电生成氨气与氢气,结合电荷守恒、原子守恒写出电极反应;
(2)反应②是氨的催化氧化生成一氧化氮和水;
(3)反应④为Mg与二氧化碳的反应生成MgO与碳;
(4)从MgCl2溶液制备MgCl2的无水晶体,应注意防止水解;
(5)反应⑤是碳与浓硝酸反应生成CO2、NO2、H2O;
(6)氨气溶于水呈碱性,所以氨气遇到湿润的红色石蕊试纸变蓝;
(7)E为氨气,K与氨气组成元素相同,且为18电子,则K的分子式为N2H4;
解答 解:C为无色液体,由气体X(X由原电池反应得到,可能是H2)和氧气反应得到,故C应是H2O,X是H2;根据反应⑦可知非金属Y是C;由电解D无水晶体得到A与Cl2,可知D为氯化物且是离子化合物,结合A+B溶液发生原电池反应得到X、D、E,可知B为氯化物,且B是一种盐,受热极易分解,反应生成的H2与E气体,B应水解呈酸性,由转化关系:E→F→G→H,属于常温下气体E的连续氧化得到气体G,在中学阶段中N、S元素化合物符合转化关系,考虑反应①是金属与NH4Cl溶液发生的原电池反应,可推出E为NH3、F为NO、G为NO2,则H为HNO3;(1)中反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,应为Mg与二氧化碳的反应,可推出A为Mg,则D为MgCl2;结合反应①可推知B为NH4Cl,验证符合转化关系,
(1)原电池反应①中,正极发生还原反应,铵根离子放电生成氨气与氢气,正极反应式为:2NH4++2e-=2NH3↑+H2↑,
故答案为:2NH4++2e-=2NH3↑+H2↑;
(2)反应②是氨的催化氧化,反应化学方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应④为Mg与二氧化碳的反应生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)从MgCl2溶液制备MgCl2的无水晶体,应注意防止水解,操作b是应将氯化镁溶液在HCl气流中蒸干,
故答案为:在HCl气流中蒸干;
(5)反应⑤是碳与浓硝酸反应生成CO2、NO2、H2O,方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(6)氨气溶于水呈碱性,所以氨气遇到湿润的红色石蕊试纸变蓝,通常利用此方法检验氨气,
故答案为:湿润的红色石蕊试纸,变蓝.
(7)E为氨气,K与氨气组成元素相同,且为18电子,则K的分子式为N2H4,其电子式为: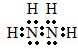 ,所含化学键类型为极性共价键、非极性共价键,
,所含化学键类型为极性共价键、非极性共价键,
故答案为:极性共价键,非极性共价键;
点评 本题考查无机物的推断,题目难度中等,侧重于学生的分析能力和元素化合物知识的综合运用的考查,为高考常见题型,注意把握题给信息,结合转化关系进行推断,该原电池实质为铵根离子水解,Mg再与氢离子反应生成氢气.

 阅读快车系列答案
阅读快车系列答案| A. | 14 | B. | 28 | C. | 31 | D. | 35.5 |
 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.a.低温高压 b.加入催化剂 c.体积不变充入氦气
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g),在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.04 mol•L-1•min-1.若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
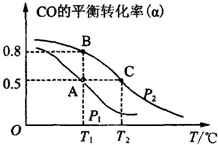
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)═CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2,用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为O2+2H2O+4e-=4OH-.
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | SCN-、Fe3+、K+、Cl- |
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,结论:原溶液一定有Fe2+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
| A. | 氢氟酸 | B. | 浓盐酸 | C. | 溴水 | D. | 碘化银固体 |
| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.