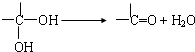
题目内容
9.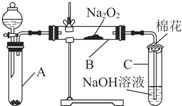 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
分析 (1)移开棉花,将带火星的木条放在C试管口,未见木条复燃说明无氧气生成,二氧化硫和过氧化钠反应生成硫酸钠;
(2)固体亚硫酸钠和浓硫酸反应生成的气体中含有水蒸气,与过氧化钠反应生成氧气;验证二氧化硫与过氧化钠反应的产物需要在AB间连接干燥装置;
(3)依据假设设计实验检验硫酸根离子和亚硫酸根离子的检验试剂和检验方法设计,硫酸根离子检验利用盐酸和氯化钡容易进行检验,亚硫酸根离子利用高锰酸钾溶液检验;
(4)①碘单质溶液滴定和溶液中的亚硫酸钠反应,恰好反应后滴入碘水变蓝色半分钟内部褪色证明反应完全;
②依据化学方程式H2O+SO32-+I2=2I-+SO42-+2H+,可得关系式Na2SO3~I2,据此计算.
解答 解:(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,无氧气生成,SO2与Na2O2的反应不同于CO2,二氧化硫和过氧化钠反应生成硫酸钠,反应的化学方程式为:SO2+Na2O2=Na2SO4,故答案为:SO2+Na2O2=Na2SO4;
(2)乙同学认为无论反应原理如何,最终都有O2产生,是因为A装置生成的二氧化硫气体中含有水蒸气,和过氧化钠反应生成氧气,试验为了验证二氧化硫与过氧化钠反应的产物,需要在AB装置间连接呈浓硫酸的洗气瓶装置吸收水蒸气,
故答案为:A中生成的SO2气体中含有水蒸气;在A和B之间连接一个装有浓硫酸的洗气瓶;
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
步骤1,取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中,固体全部溶解;往Ⅰ试管中加入足量的1 mol•L-1盐酸,再滴加1 mol•L-1 BaCl2溶液,有白色沉淀生成,则证明生成物中含Na2SO4;往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液,振荡,若KMnO4溶液紫红色褪去,则说明生成物中有Na2SO3;若KMnO4溶液紫红色不褪去,则说明生成物中没有Na2SO3,
故答案为:
| 步骤2:往Ⅰ试管中加入 足量的1_ mol•L-1盐酸,再滴加 1_ mol•L-1_ BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4 |
| 步骤3:往Ⅱ试管中 加入2~3滴0.01_ mol•L-1_ KMnO4酸性溶液,振荡 | 若 KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3; |
| 若 KMnO4溶液紫红色不褪去,则说明生成物中没有Na2SO3 |
故答案为:溶液出现蓝色,且半分钟内不褪去;
②取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol•L-1碘水进行滴定,平均消耗碘水20.00mL,依据离子方程式计算
I2+SO32-+H2O=SO42-+2I-+2H+;碘单质物质的量和亚硫酸钠物质的量相同=0.020L×0.010mol/L=2×10-4mol;所以100ml溶液中亚硫酸钠物质的量为2×10-3mol
生成物中亚硫酸钠的质量分数=$\frac{{0.02L×0.0100mol/L×126g/mol×\frac{100mL}{10mL}}}{ag}$×100%=$\frac{0.252}{a}$×100%,
故答案为:$\frac{0.252}{a}$×100%.
点评 本题考查了物质性质的实验验证和混合物成分的实验验证,掌握物质性质和离子性质是解题关键,题目难度中等.

 同步奥数系列答案
同步奥数系列答案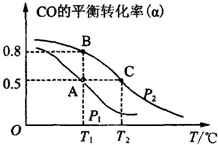 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.a.低温高压 b.加入催化剂 c.体积不变充入氦气
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g),在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH3OH)=0.04 mol•L-1•min-1.若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)═CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2,用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为O2+2H2O+4e-=4OH-.
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动(或提高乙醇的转化率,提高溴乙烷的产率等);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷的沸点和正丁醇相差较小,正丁醇会随1-溴丁烷同时蒸出.
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,
1-溴丁烷在下层(填“上层”、“下层”或“不分层”),加入NaHSO3溶液的目的是除去产物中杂质溴.
(5)将实验(4)所得的1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g.NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%.(保留2位有效数字)
| A. |  中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. |  的命名为2-甲基-1-丙醇 的命名为2-甲基-1-丙醇 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) |
| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
| A. |  系统命名:2-乙基丙烷 系统命名:2-乙基丙烷 | |
| B. | 由分子式为C2H6O组成的物质一定是纯净物 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 互为同系物的物质,在组成和结构上相似,所以化学性质也相似 |
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20 mol | D. | 大于0.20 mol,小于0.40 mol |
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.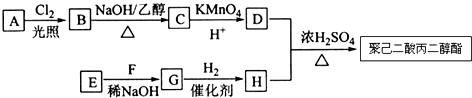
 .
. .
.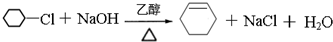 .
.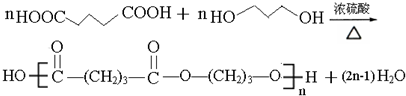 .
.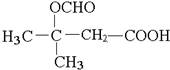 (写出其中一种结构简式).
(写出其中一种结构简式).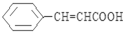 )的合成路线示意图.
)的合成路线示意图.