题目内容
16.将 4molA气体和 2molB气体在 2L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得 C 的浓度为 0.6mol•L-1,现有下列几种说法,其中正确的是( )| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 |
分析 若经2s后测得 C 的浓度为 0.6mol•L-1,生成C的物质的量为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
2s 2.8 1.4 1.2
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:若经2s后测得 C 的浓度为 0.6mol•L-1,生成C的物质的量为0.6mol/L×2L=1.2mol,则
2A(g)+B(g)?2C(g)
开始 4 2 0
转化 1.2 0.6 1.2
2s 2.8 1.4 1.2
A.用物质 A 表示的反应的平均速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3 mol•L-1•s-1,故A正确;
B.用物质 B 表示的反应的平均速率为$\frac{\frac{0.6mol}{2L}}{2s}$=0.15 mol•L-1•s-1,故B错误;
C.2 s 时物质 A 的转化率为$\frac{1.2}{4}$×100%=30%,故C错误;
D.2 s 时物质 B 的浓度为$\frac{1.4mol}{2L}$=0.7 mol•L-1,故D正确;
故选AD.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率和速率的计算为解答的关键,侧重分析与计算能力的考查,注意反应中物质的量关系,题目难度不大.

| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
| A. | 参加反应的Na2O2为(x+y)mol | |
| B. | 反应后容器内有O2 (x+y) mol | |
| C. | 反应前后容器内压强之比为(温度不变):(x+y+z)/z | |
| D. | 反应后生成了x mol Na2CO3 和2y mol NaOH |

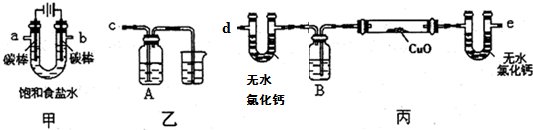

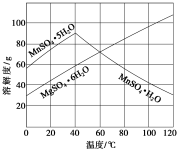 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.