题目内容
8.已知反应N2(g)+O2(g)?2NO(g),在2216K时的K=1.6×10-3.反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)在2216K下的平衡常数为250.分析 互为相反过程的反应,K互为倒数,化学反应中化学计量数为倍数关系时K为指数关系,以此来计算.
解答 解:N2(g)+O2(g)?2NO(g),在2216K时的K=1.6×10-3.
则$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)?NO(g),在2216K时的K1=$\sqrt{1.6×1{0}^{-3}}$=4×10-2;
所有NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)在2216K下的平衡常数为$\frac{1}{4×1{0}^{-2}}$=250,
故答案为:250.
点评 本题考查化学平衡常数的计算,为高频考点,把握平衡常数的含义、化学反应中化学计量数与K的表达式的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
19.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |
16.将 4molA气体和 2molB气体在 2L 固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g).若经2s后测得 C 的浓度为 0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 |
3.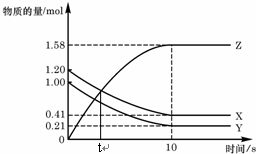 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
13.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可人肺颗粒物.下列有关说法中,错误的是( )
| A. | 雾屑于胶体,能产生丁达尔现象 | |
| B. | 大雾的形成与汽车的尾气排放没有关系 | |
| C. | 持续大雾天气给农业生产、交通运输等带来很大的影响 | |
| D. | 空气中悬浮的细小颗粒物严重危害人体健康 |
20.x、y、z为三种气体,把a mol x和b mol y充入一密闭容器中,发生反应,x+2y?2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为( )
| A. | $\frac{a+b}{5×100%}$ | B. | $\frac{2(a+b)}{5b×100%}$ | C. | $\frac{200(a+b)}{5b}$% | D. | $\frac{(a+b)}{5a×100%}$ |
17.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | H2 | B. | CH4 | C. | HCl | D. | Cl2 |
18.化学与生产、生活密切相关,下列说不正确的是( )
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 利用丁达尔效应鉴别 Fe(OH)3胶体和FeCl3溶液 |