题目内容
6.实验室中,用如图1所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率.
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ/mol;SO3熔点为16.8℃.假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2.
(1)根据实验目的,请从上面如图2中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置ⅠB,装置ⅡA,装置ⅢD.
(2)开始进行实验时,首先应进行的操作是检查装置气密性.
(3)加热硬质玻璃管时,若不断升高温度,SO2的转化率会减小(填“增大”、“不变”或“减小”)
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是继续通入氧气一段时间.
(5)实验结束后,若装置Ⅱ增加的质量为b g,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是$\frac{4b}{4b+5a}$×100%;过程中反应放出热量为1.223bkJ(用含字母的代数式表示).
分析 (1)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,Ⅲ中为吸水和尾气处理;
(2)气体的制备及性质实验中需要检查装置的气密性;
(3)根据(1)中的热化学方程式,升温平衡向逆反应方向进行判断;
(4)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收;
(5)依据硫元素守恒计算得到反应生成的三氧化硫物质的量,和剩余二氧化硫被氢氧化钠吸收的物质的量,根据转化率概念计算;结合三氧化硫的物质的量及热化学方程式2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ/mol计算.
解答 解:(1)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,Ⅲ中应该加氢氧化钠溶液尾气处理装置,
故答案为:B;A;D;
(2)实验前,必须进行的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(3)根据(1)中的热化学方程式,升温平衡向逆反应方向进行,所以SO2的转化率会减小,
故答案为:减小;
(4)为使残留在装置中的SO2、SO3被充分吸收,用氧气把装置中的二氧化硫和三氧化硫赶到A装置中吸收三氧化硫,二氧化硫赶入D装置中被氢氧化钠溶液吸收,
故答案为:继续通入氧气一段时间;
(5)已知Ⅱ增加的质量为b g即三氧化硫的质量,因此,反应生成三氧化硫的二氧化硫物质的量=$\frac{bg}{80g/mol}$=$\frac{b}{80}$mol;装置Ⅲ增加的质量为a g即被氢氧化钠吸收的剩余二氧化硫物质的质量,因此,剩余的二氧化硫物质的量=$\frac{ag}{64g/mol}$=$\frac{a}{64}$mol,
所以二氧化硫的转化率=$\frac{\frac{b}{80mol}}{\frac{b}{80}mol+\frac{a}{64}mol}$×100%=$\frac{4b}{4b+5a}$×100%;
反应生成$\frac{b}{80}$mol三氧化硫,根据反应2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ/mol可知反应放出热量为:196.6kJ/mol×$\frac{1}{2}$×$\frac{b}{80}$mol≈1.223bkJ,
故答案为:$\frac{4b}{4b+5a}$×100%;1.223bkJ.
点评 本题考查工业制硫酸的方法,题目难度中等,涉及二氧化硫的性质、化学平衡的影响因素、计算以及化学方程式的书写等知识,明确实验原理为解答关键,试题综合性较强,充分考查学生分析和解决问题的能力,侧重实验及计算能力的考查.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | CH4 | B. | NH4+ | C. | Cl- | D. | NH2- |
| A. | D的浓度减小了 | B. | A的转化率减小了 | ||
| C. | 物质B的质量分数增加了 | D. | a+b>c+d |
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
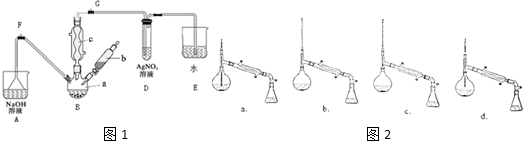
请分析后回答下列问题.
(1)打开G处止水夹,关闭F处止水夹,在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,继续滴加至液溴滴完,三颈烧瓶中发生反应的化学方程式为
 .
.(2)液溴滴完后,打开F处止水夹,关闭G处止水夹,一段时间后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的Fe;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,再经过分液,(填实验操作名称)分离出的粗溴苯,再中加入少量的无水氯化钙,静置、过滤.
(3)经以上分离操作后,要把粗溴苯进一步提纯,进行的实验操作中,仪器选择及安装都正确的是如图2:b(填字母)锥形瓶中得到的主要物质是苯(填物质名称).
(4)D中试管内出现的现象是溶液中有淡黄色沉淀生成,某同学认为不能因此证明苯和液溴的反应是取代反应,若要证明,需改进的实验操作是在B、D间安装一个装有CCl4溶液的洗气瓶.
(5)本实验存在一个明显不足之处是制溴苯过程中装置D、E中的溶液容易倒吸入装置B,导致实验失败.
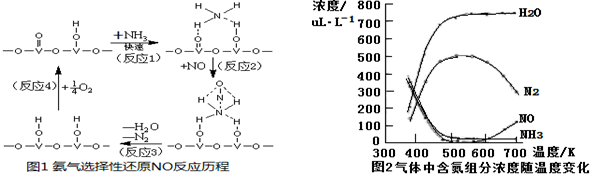
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
| A. | 向装置中通入氮气且保持体积不变 | |
| B. | 向装置中通入稍过量氧气且保持体积不变 | |
| C. | 添加更多的催化剂 | |
| D. | 降低温度,及时转移SO3 |
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 |