题目内容
(1)在2mL 0.1mol/L的NaCl溶液中,加入2mL 0.1mol/L的AgNO3溶液,可观察到 ,此反应的离子方程式为 ,将此混合液过滤,滤渣加入2mL 0.1mol/L的KI溶液,搅拌,可观察到 ,反应的离子方程式为 .
(2)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp的表达式为
(3)下列说法不正确的是 .
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
(2)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp的表达式为
(3)下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全.
考点:难溶电解质的溶解平衡及沉淀转化的本质,离子方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)反应生成氯化银和硝酸钠,观察到白色沉淀,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI;
(2)依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积等于溶液中离子浓度幂次方乘积;
(3)A、依据氯化银沉淀溶解平衡分析,银离子浓度增大,平衡向沉淀方向进行;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;
C、氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;
D、Mg(OH)2的溶解度比MgCO3小;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全.
(2)依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积等于溶液中离子浓度幂次方乘积;
(3)A、依据氯化银沉淀溶解平衡分析,银离子浓度增大,平衡向沉淀方向进行;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;
C、氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;
D、Mg(OH)2的溶解度比MgCO3小;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全.
解答:
解:(1)反应生成氯化银和硝酸钠,观察到白色沉淀,离子反应为Ag++Cl-=AgCl↓,AgCl中加入2mL0.1mol/L的KI溶液发生沉淀的转化,生成AgI,观察到白色沉淀转化为黄色沉淀,离子反应为AgCl(s)+I-?AgI(s)+Cl-,
故答案为:白色沉淀;Ag++Cl-=AgCl↓;白色沉淀转化为黄色沉淀;AgCl(s)+I-?AgI(s)+Cl-;
(2)对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,
Ksp=[Ag+]2?[S2-];故答案为:c(Ag+)2?c(S2-);
(3)A、氯化银沉淀溶解平衡中存在溶度积常数,Ksp=[Ag+][Cl-],银离子浓度增大,平衡向沉淀方向进行;用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;故B错误;
C、氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;故C正确;
D、Mg(OH)2的溶解度比MgCO3小;故D错误;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全;故E正确;
综上所述:BD错误;
故选BD.
故答案为:白色沉淀;Ag++Cl-=AgCl↓;白色沉淀转化为黄色沉淀;AgCl(s)+I-?AgI(s)+Cl-;
(2)对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,
Ksp=[Ag+]2?[S2-];故答案为:c(Ag+)2?c(S2-);
(3)A、氯化银沉淀溶解平衡中存在溶度积常数,Ksp=[Ag+][Cl-],银离子浓度增大,平衡向沉淀方向进行;用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;故B错误;
C、氢氧化铝是难溶物质,存在沉淀溶解平衡和电离平衡;故C正确;
D、Mg(OH)2的溶解度比MgCO3小;故D错误;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全;故E正确;
综上所述:BD错误;
故选BD.
点评:本题考查离子反应方程式的书写,沉淀溶解平衡的计算应用,平衡移动的影响因素,难溶物质的溶解度比较方法,题目难度中等.

练习册系列答案
相关题目
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
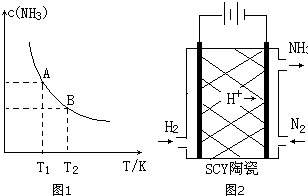 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.