题目内容
5.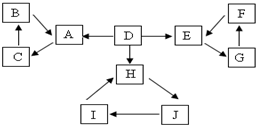 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:
A、B、C、D、E、F、G、H、I、J有如图所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见表:| 编号 | 信息 | 编号 | 信息 |
| 1 | D为地壳中含量最高的元素组成的单质 | 4 | H为淡黄色固体化合物 |
| 2 | E为酸性气态氧化物 | 5 | 电解饱和J溶液是工业重要反应 |
| 3 | F的浓溶液常做干燥剂 | 6 | C为离子化合物,阴、阳离子均含金属元素 |
(1)A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素在周期表中的位置第三周期第IIIA族;
(2)指出H中化学键类型离子键和共价键,写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式
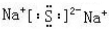 .
.(3)常温下C溶液的PH<7,(填“<”、“>”或“=”)写出C溶液中通入少量盐酸生成B的化学方程式HCl+NaAlO2+H2O=Al(OH)3↓+NaCl.写出C溶液中滴加NaHCO3溶液的离子方程式AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-.
(4)Zn和Cu分别和一定量F的浓溶液反应,若产生的气体体积相等(相同条件下),则下列判断正确的是BD
A.产生的气体种类一定相同 B.转移的电子一定相同
C.消耗F的物质的量一定相同 D.消耗两种金属物质的量一定相同
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应,生成三种含Y元素的离子,其中YO3-、YO-两种离子物质的量之比为1:2,该反应的离子方程式是10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
分析 所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素;D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性气态氧化物,F的浓溶液常做干燥剂,为浓硫酸,E、F中含有共同第三周期元素S元素,F反应生成E,则E为SO2,E反应生成G、G反应生成F,则G为SO3;
H为淡黄色固体化合物,D是氧气,则H为Na2O2,电解饱和J溶液是工业重要反应,H、J含有相同第三周期元素,为Na元素,J为NaCl,电解熔融的氯化钠得到Na,Na和氧气反应生成过氧化钠,则I为Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,结合转化关系,可知A是Al2O3,B是Al(OH)3,结合题目分析解答.
解答 解:所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素;D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性气态氧化物,F的浓溶液常做干燥剂,为浓硫酸,E、F中含有共同第三周期元素S元素,F反应生成E,则E为SO2,E反应生成G、G反应生成F,则G为SO3;
H为淡黄色固体化合物,D是氧气,则H为Na2O2,电解饱和J溶液是工业重要反应,H、J含有相同第三周期元素,为Na元素,J为NaCl,电解熔融的氯化钠得到Na,Na和氧气反应生成过氧化钠,则I为Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,结合转化关系,可知A是Al2O3,B是Al(OH)3,
(1)A是氧化铝、E是二氧化硫、H为过氧化钠,A、E、H中原子序数最大的元素的元素符号S,A、B、C共同含有的元素为Al,Al在周期表中的位置是第三周期第IIIA族,
故答案为:S;第三周期第IIIA族;
(2)H为过氧化钠,H中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,所以化学键类型是离子键和共价键,与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物为Na2S,硫化钠的电子式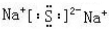 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键;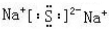 ;
;
(3)C是偏铝酸钠,偏铝酸根离子水解导致常温下C溶液的PH<7,偏铝酸钠和少量稀盐酸反应生成氢氧化铝沉淀和NaCl,反应方程式为HCl+NaAlO2+H2O=Al(OH)3↓+NaCl,偏铝酸钠和碳酸氢钠反应生成氢氧化铝沉淀和碳酸钠,离子反应方程式为AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,
故答案为:<;HCl+NaAlO2+H2O=Al(OH)3↓+NaCl;AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-;
(4)Zn和Cu分别和一定量F的浓溶液反应,Zn能和稀硫酸反应但Cu和稀硫酸不反应,
A.Zn生成的气体有二氧化硫和氢气,Cu反应只生成二氧化硫,所以产生的气体种类不相同,故错误;
B.Zn、Cu反应后都生成二价金属阳离子,生成气体的体积相同,则转移的电子一定相同,故正确;
C.Zn反应中氢离子和硫酸根离子都发生氧化还原反应、Cu反应中只有硫酸根离子发生还原反应,所以消耗F的物质的量不相同,故错误;
D.转移电子相同,每摩尔金属失电子物质的量相同,所以消耗两种金属物质的量一定相同,故正确;
故选BD;
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,为该气体是氯气,两者恰好完全反应,生成三种含Y元素的离子,其中ClO3-、ClO-两种离子物质的量之比为1:2,假设ClO3-、ClO-两种离子物质的量分别是xmol、2xmol,根据转移电子守恒得n(Cl-)=$\frac{1mol×5+2mol×1}{1}$=7mol,再结合电荷守恒及原子守恒配平离子方程式为10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O,
故答案为:10OH-+5Cl2=2ClO-+ClO3-+7Cl-+5 H2O.
点评 本题考查无机物推断,为高频考点,涉及物质推断、氧化还原反应、化学方程式的计算、离子方程式书写、化学用语等知识点,侧重考查学生推断及知识综合应用,明确化学反应原理、元素化合物性质是解本题关键,注意(4)中Zn和稀硫酸反应还生成氢气,但Cu不反应,为易错点.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案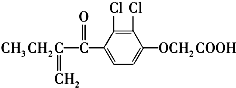 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:下列叙述正确的是( )
| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
| A. | MnO4-→Mn2+ | B. | NaOH→NaCl | C. | Na2SO3→SO2 | D. | CO→CO2 |
| A. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 | |
| B. | 正戊烷分子中所有原子均在一条直线上 | |
| C. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定符合通式CnH2n+2 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| A. | 常温常压下1molO2与其他物质发生反应时转移的电子数一定为4NA | |
| B. | 1L 0.1 mol/L的Na2CO3溶液中,Na+、CO32-总数为0.3 NA | |
| C. | 28g C18O中含有的质子数为14 NA | |
| D. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA |
 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.