题目内容
20.下列离子方程式错误的是( )| A. | 向硫酸氢钠溶液中滴加氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| C. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HS03- | |
| D. | 向明矾溶液中滴加少量Ba(OH)22Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
分析 A.硫酸氢钠与氢氧化钡溶液反应生成硫酸钡沉淀和水;
B.双氧水被酸性高锰酸钾溶液氧化成氧气;
C.二氧化硫过量,次氯酸完全反应生成氯离子;
D.氢氧化钡少量,离子方程式按照氢氧化钡的化学式书写.
解答 解:A.向硫酸氢钠溶液中滴加氢氧化钡溶液,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O,故A正确;
B.酸性介质中KMnO4氧化H2O2,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故B正确;
C.NaClO溶液中通入过量SO2,二者发生氧化还原反应,正确的离子方程式为:ClO-+SO2+H2O=Cl-+2H++S042-,故C错误;
D.向明矾溶液中滴加少量Ba(OH)2,反应生成氢氧化铝和硫酸钡沉淀,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故D正确;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
11.下列物质能由两种单质直接化合得到的是( )
| A. | FeCl2 | B. | CuS | C. | NO2 | D. | SO2 |
15.下列说法正确的是( )
| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |
12.下列各组中的X和Y两种原子,化学性质一定相似的是( )
| A. | X原子和Y原子最外层都只有一个电子 | |
| B. | X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 | |
| C. | X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2 | |
| D. | X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子 |
9.甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是( )
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
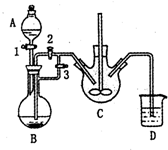 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: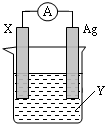 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题: .
.