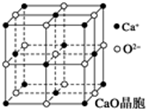
题目内容
5.某溶液可能含有Cl-、SO42-、I-、NH4+、Fe3+、Al3+和K+、Ag+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;经过虑,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中(1)该溶液中至少存在4种离子,
(2)一定不存在的离子有I-、Al3+、Ag+,一定存在的离子有Cl-、SO42-、NH4+、Fe3+,一定存在的阴离子浓度0.2mol/L.
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有I-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为:0.02mol,一定不存在Ag+.根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有I-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为0.02mol,一定不存在Ag+.由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,
(1)由上述分析可知,一定含Cl-、SO42-、NH4+、Fe3+四种离子,故答案为:4;
(2)一定不存在的离子有I-、Al3+和Ag+,4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为0.02mol,浓度是$\frac{0.02mol}{0.1L}$=0.2mol/L,故答案为:I-、Al3+、Ag+;Cl-、SO42-、NH4+、Fe3+;0.2mol/L.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
20.下列离子方程式错误的是( )
| A. | 向硫酸氢钠溶液中滴加氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| C. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HS03- | |
| D. | 向明矾溶液中滴加少量Ba(OH)22Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: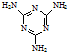 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.