题目内容
15.下列说法正确的是( )| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |
分析 A.胶体是分散系;
B.海水中提取镁: ;
;
C.光导纤维的成分是二氧化硅;
D.铝离子和铁离子属于弱根离子,能水解生成氢氧化铝和氢氧化铁胶体;
解答 解:A.纳米碳酸钙只有一种物质,不是分散系,故A错误;
B.氢氧化镁和盐酸反应不是氧化还原反应,故B错误;
C.光导纤维的成分是二氧化硅,不是硅酸盐,故C错误.
D.铝离子和铁离子属于弱根离子,能水解生成氢氧化铝和氢氧化铁胶体,胶体具有吸附性,能吸附悬浮物而净水,故D正确;
故选D.
点评 本题考查分散系、物质的分类等,题目难度不大,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
5.面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锌粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
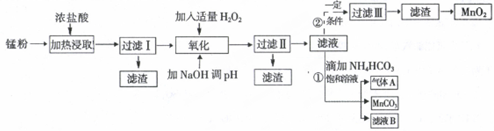
根据以上信息回答问题:
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
6.有a、b、c、d四种金属.将a与b用导线连接起来,浸入电解质溶液中,外电路电流从b流向a.将a、d分别投入到等浓度盐酸中,d比a反应剧烈.将铜浸入b的盐溶液中,无明显变化.如果把铜浸入c的盐溶液中,有金属c析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | dcab | B. | dabc | C. | dbca | D. | dbac |
3.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②③可以 | D. | ①③④可以 |
10.CH3COOH分子中-CH3及-COOH中碳原子的杂化类型分别是( )
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |
20.下列离子方程式错误的是( )
| A. | 向硫酸氢钠溶液中滴加氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| C. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HS03- | |
| D. | 向明矾溶液中滴加少量Ba(OH)22Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
5.在某酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Al3+、SO42-、HCO3- | B. | Cu2+、Mg2+、SO42-、NO3- | ||
| C. | Na+、K+、ClO-、SO42- | D. | Fe3+、K+、SO42-、I- |