题目内容
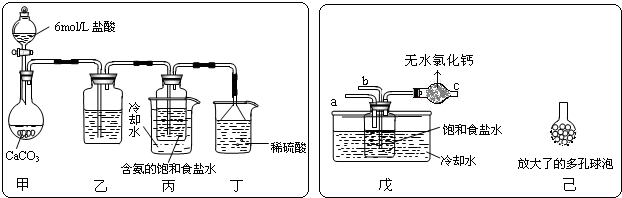
1. 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
分析 (1)0~8min,v(CO)=$\frac{△c}{△t}$;
(2)能够改变平衡时c(CO)/c(CO2)的比值说明平衡发生移动或加入两种物质中的一种;
(3)i.Fe(s)+CO2(g)?FeO(s)+CO(g),K1=$\frac{c(CO)}{c(C{O}_{2})}$
ii.Fe(s)+H2O(g)?FeO(s)+H2(g),K2=$\frac{c({H}_{2})}{c({H}_{2}O)}$
方程式i-ii得CO2(g)+H2(g)?CO(g)+H2O(g)则K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$=$\frac{{K}_{1}}{{K}_{2}}$,
据此计算不同温度下的K值,
升高温度,化学平衡向吸热方向移动.
解答 解:(1)0~8min,v(CO)=$\frac{△c}{△t}$=$\frac{0.50mol/L-0}{8min}$=0.0625mol/(L.min),故答案为:0.0625;
(2)能够改变平衡时c(CO)/c(CO2)的比值说明平衡发生移动或加入两种物质中的一种,
A.升高温度反应向吸热方向移动,则该比值一定发生变化,故A正确;
B.Fe粉的量改变,不改变浓度,平衡不移动,则该比值不发生变化,故B错误;
C.改变压强,平衡不移动,则该比值不发生变化,故C错误;
D.改变CO的量平衡发生移动,所以该比值发生变化,故D正确;
故选AD;
(3)i.Fe(s)+CO2(g)?FeO(s)+CO(g),K1=$\frac{c(CO)}{c(C{O}_{2})}$
ii.Fe(s)+H2O(g)?FeO(s)+H2(g),K2=$\frac{c({H}_{2})}{c({H}_{2}O)}$
方程式i-ii得CO2(g)+H2(g)?CO(g)+H2O(g)则K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$=$\frac{{K}_{1}}{{K}_{2}}$,
①温度为973K时:K=$\frac{1.47}{2.38}$=0.62,故答案为:0.62;
②温度为1173K时:K=$\frac{2.15}{1.67}$=1.29,故答案为:1.29;
③升高温度,该反应的化学平衡常数增大,则该反应向正反应方向移动,升高化学平衡向吸热方向移动,所以正反应是吸热反应,故答案为:吸热.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意(3)中总方程式K不等于K1+K2.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
| A. |  | B. |  | C. |  | D. |  |

(1)操作Ⅰ使用的试剂是CCl4,所用主要仪器的名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.
用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2.
酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
(4)工业上由熔融MgCl2制Mg,写出化学方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)化学使生活更美好,下列做法不可行的是AF.
A.用活性炭检验软、硬水 B.用食醋除铁锈
C.用小苏打片治疗胃酸过多 D.用生石灰作食品干燥剂
E.乙烯可以作水果催熟剂 F.福尔马林可以作食品保鲜剂.
 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、10.0g(0.1mol)环已醇和15mL 环已烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL98% 浓硫酸,恒压滴液漏斗换成分水器装置,加热回流90min,将反应液依次加水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168~174℃的馏分,得到无色透明有香味的液体,得产品6.9g
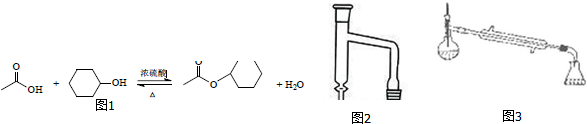
(1)上述反应装置图2中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环已醇的2 倍,其目的是提高环已醇的转化率.
(3)使用分水器(图3)的目的是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用10%的NaHCO3溶液目的是洗去硫酸和醋酸;第二次水洗 的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验产率为48.6%.
(6)若在进行蒸馏操作时,采用图3装置,会使实验的产率偏高 (填“偏高”“偏低”“无影响”),其原因是产品中会收集到未反应的环己醇.
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2-→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 空气 | B. | 氨水 | C. | 矿泉水 | D. | 蒸馏水 |
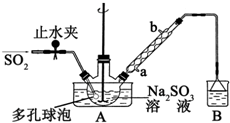 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: