题目内容
11.硫酸镁还原热解制高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3等不溶性杂质)为原料制备高纯氧化镁的实验流程如图: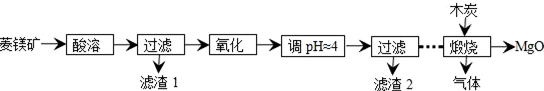
(1)MgCO3在酸溶时的化学反应方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)氧化过程中需要加入氧化剂,该氧化剂的最佳选择是H2O2.
(3)滤渣2的成分是Fe(OH)3;其Ksp的最大值约为1×10-35.
(4)煅烧过程存在以下反应:2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
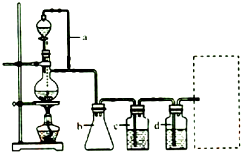
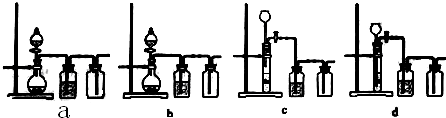
①实验室中煅烧需要的仪器除酒精灯、三脚架以外,还需要BC.
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
利用如图装置对煅烧产生的气体分别进行吸收或收集

②D中收集的气体是CO.
③B中盛放的溶液可以是d(填字母).
a.NaOH溶液 b.Na2CO3溶液c.稀硝酸 d.KMnO4溶液
④A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:3S+6OH-2$\frac{\underline{\;加热\;}}{\;}$S2-+SO32-+3H2O.
分析 以菱铁矿(主要成分为MgCO3,含少量FeCO3)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤渣1为不溶物,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH沉淀铁离子,过滤得到滤渣2为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,和木炭高温煅烧制备高纯氧化镁.
(1)MgCO3和H2SO4发生复分解反应生成MgSO4、H2O和CO2,根据反应物和生成物的质量守恒书写方程式;
(2)加入的氧化剂能氧化亚铁离子转化为铁离子且不能引进新的杂质;
(3)通过以上分析知,滤渣2是Fe(OH)3;溶液的pH=4,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,当溶液中c(Fe3+)≤10-5 mol/L时Fe3+完全沉淀,据此计算Ksp[Fe(OH)3];
(4)①灼烧固体药品的仪器是坩埚,需要在泥三角上进行加热;
②煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收SO2,通过C中的氢氧化钠溶液吸收CO2,最后剩余CO气体在D中收集;
③B溶液的目的是吸收SO2但不能吸收CO2,所以该处溶液应该具有强氧化性,能和SO2反应但不能产生新的杂质;
④氧化还原反应中有化合价升高的物质也有化合价降低的物质,产物中元素最高价态为+4,NaOH没有氧化性,所以只能是S发生歧化反应,S元素化合价降低为-2价,所以该离子反应产物有S2-和SO32.
解答 解:(1)MgCO3和H2SO4发生复分解反应生成MgSO4、H2O和CO2,根据反应物和生成物书写方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑,
故答案为:MgCO3+H2SO4═MgSO4+H2O+CO2↑;
(2)加入被称作绿色氧化剂的H2O2,故答案为:H2O2;
(3)通过以上分析知,滤渣2是Fe(OH)3;溶液的pH=4,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,当溶液中c(Fe3+)≤10-5 mol/L时Fe3+完全沉淀,Ksp[Fe(OH)3]=c(OH-)3.c(Fe3+)=(10-10)3.10-5=1×10-35,
故答案为:Fe(OH)3;1×10-35;
(4)①灼烧固体药品的仪器是坩埚,需要在泥三角上进行加热,所以还需要的仪器是坩埚和泥三角,
故选BC;
②煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收SO2,通过C中的氢氧化钠溶液吸收CO2,最后剩余CO气体在D中收集,
故答案为:CO;
③B溶液的目的是吸收SO2但不能吸收CO2,所以该处溶液应该具有强氧化性,能和SO2反应但不能产生新的杂质,
a.NaOH溶液能吸收二氧化碳,且没有强氧化性,不符合条件,故错误;
b.Na2CO3溶液能吸收二氧化碳,且没有强氧化性,不符合条件,故错误;
c.稀硝酸具有强氧化性,但不能吸收二氧化硫,故错误;
d.KMnO4溶液具有强氧化性,且能吸收二氧化硫,故正确;
故选d;
④氧化还原反应中有化合价升高的物质也有化合价降低的物质,产物中元素最高价态为+4,NaOH没有氧化性,所以只能是S发生歧化反应,S元素化合价降低为-2价,所以该离子反应产物有S2-和SO32-,根据反应物和生成物及反应条件知,该离子反应方程式为3S+6OH-$\frac{\underline{\;加热\;}}{\;}$2S2-+SO32-+3H2O,
故答案为:3S+6OH-2$\frac{\underline{\;加热\;}}{\;}$S2-+SO32-+3H2O.
点评 本题考查物质分离和提纯,为高频考点,涉及氧化还原反应、除杂、物质检验、仪器的选取、溶度积常数等知识点,综合性较强,明确反应原理、基本操作、仪器的用途、难溶物溶解平衡等即可解答,注意除杂时要除去杂质且不能引进新的杂质,易错点是(4)③题,注意SO2和CO2混合气体检验先后顺序及所用的试剂,题目难度中等.

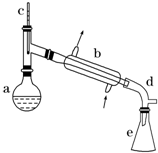 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: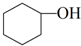 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%

(1)操作Ⅰ使用的试剂是CCl4,所用主要仪器的名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.
用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2.
酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
(4)工业上由熔融MgCl2制Mg,写出化学方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)化学使生活更美好,下列做法不可行的是AF.
A.用活性炭检验软、硬水 B.用食醋除铁锈
C.用小苏打片治疗胃酸过多 D.用生石灰作食品干燥剂
E.乙烯可以作水果催熟剂 F.福尔马林可以作食品保鲜剂.
| A. | v(B)=1.5 mol•L-1•min-1 | B. | v(B)=3 mol•L-1•min-1 | ||
| C. | v(D)=2 mol•L-1•min-1 | D. | v(C)=1 mol•L-1•min-1 |
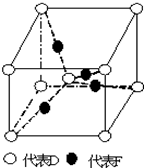 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.