题目内容
5.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、标况下,三氧化硫为固体;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析;
D、氯气所处的状态不明确.
解答 解:A、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为n=$\frac{92g}{46g/mol}$=2mol,故含6mol原子即6NA个,故A正确;
B、标况下,三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故0.1mol过氧化钠中含0.3mol离子即0.3NA个,故C错误;
D、氯气所处的状态不明确,故气体的物质的量无法计算,则和碱反应转移的电子数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.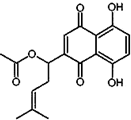 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
1.在120℃时,将1L乙烯、2L甲烷和20L氧气混合点燃,完全燃烧后,恢复到原来的温度,所得气体的体积是( )
| A. | 17L | B. | 20L | C. | 21L | D. | 23L |
10.印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3作为“腐蚀液”,生成CuCl2和FeCl2.若完全反应后,所得溶液中Cu2+和Fe3+的浓度恰好相等.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
17.下列关于硝酸参加反应的化学方程式或离子方程式书写正确的是( )
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3═Fe(NO3)3+3NO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向硝酸亚铁溶液中加入稀盐酸:3Fe2++2H++$NO_3^-$═3Fe3++NO↑+H2O | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2$NO_3^-$═Cu2++2NO2↑+2H2O |
14.下列事实能说明醋酸是弱酸的是( )
| A. | 常温下醋酸易挥发 | |
| B. | 醋酸能与水以任意比互溶 | |
| C. | 常温下0.1mol/L的醋酸钠溶液的pH约为9 | |
| D. | 10mL0.1mol/L的醋酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
15.下列实验现象和结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+,无K+ |
| D | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| A. | A | B. | B | C. | C | D. | D |